甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g) ΔH< 0。
CH3OH(g) ΔH< 0。
(1)上述反应的平衡常数表达式为K= ,以下有关说法正确的是________
a.恒温、恒容条件下,容器内的压强不发生变化则可逆反应达到平衡
b.一定条件下,H2的消耗速率是CO的消耗速率的2倍时可逆反应达到平衡
c.保持容器体积不变,升高温度可提高CO的转化率
d.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
(2)其它条件相同时,在T1、T2(T1< T2)两个不同温度下可逆反应达到平衡,请画出CO的转化率随时间变化的示意图。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH= -a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ΔH= -b kJ·mol-1
③ H2O(g)= H2O(l) ΔH= -c kJ·mol-1
则 CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=______________kJ·mol-1。
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。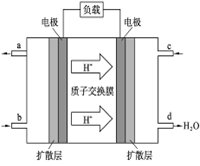
C极发生的电极反应式为:___________________________,工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有______NA个电子发生转移。
(H:1 C:12 O:16)
现代传感信息技术在化学实验中有广泛的应用。
Ⅰ.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中制取NH3的化学方程式为 ,检验三颈瓶集满NH3的方法是 。
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
Ⅱ.测定NH3•H2O的浓度及电离平衡常数Kb
(3)从三颈瓶中用 (填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据、电脑绘制滴定曲线如下图。
(4)据图,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= ,当pH=11.0时计算Kb的近似值,Kb≈ 。
(5)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水不影响测定结果 |
| B.未滴加酸碱指示剂,实验结果不科学 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏高 |
铝硅合金材料性能优良。铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 。
(2)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是 。
(3)焙烧除铁反应:4(NH4)2SO4+ Fe2O3  2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 。指出气体Ⅰ的用途 (任写一种)。
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 。指出气体Ⅰ的用途 (任写一种)。
(4)操作①包括:加水溶解、 。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为 。
(5)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式 。
(6)不计损失,投入1t铝土矿,当加入27kg纯铝后,铝硅合金中m:n = (摩尔质量:SiO2---60g/mol Al2O3---102 g/mol)。
一定条件下合成乙烯:
6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) △H1
CH2=CH2(g)+4H2O(g) △H1
已知:2H2(g)+O2(g)=2 H2O(g)△H2=-480 kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2 H2O(g) △H3=-1400 kJ•mol-1
(1)△H1= 。请标出该反应电子转移的方向和数目 。
(2)温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 。
A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM >KN
C.催化剂会影响CO2的平衡转化率
(3)若投料比n(H2)∶n(CO2)=3∶1,则图中M点时,乙烯的体积分数为 (保留两位有效 数字)。
(4)为提高CO2的平衡转化率,除改变温度外,还可采取的措施有 (任写一条)。
(5)电解法可制取乙烯(下图),电极a接电源的 极,该电极反应式为 。
糠醛(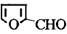 )与丙二酸合成香料过程中发生了
)与丙二酸合成香料过程中发生了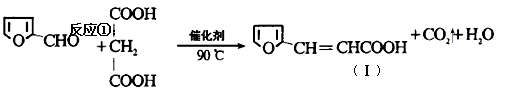
(1)糠醛的分子式为 ,1mol糠醛最多能与 mol H2反应。
(2)关于化合物Ⅰ的说法正确的是 。
| A.核磁共振氢谱中有4组信号峰 | B.能使酸性KMnO4溶液褪色 |
| C.能发生加聚反应和缩聚反应 | D.能发生取代反应和加成反应 |
(3)芳香化合物Ⅱ是化合物Ⅰ的同分异构体,能发生银镜反应,遇FeCl3溶液显紫色,任写一个Ⅱ的结构简式 。
(4)下面是由ClCH2CH2COOH合成丙二酸二乙酯的过程: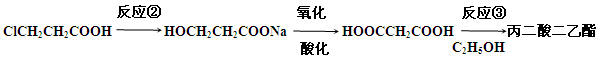
反应②的条件是 ,反应③的化学方程式为 。
(5)水杨醛(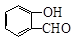 )与丙二酸可发生类似反应①的反应,写出有机产物的结构简式 。
)与丙二酸可发生类似反应①的反应,写出有机产物的结构简式 。
[《物质结构与性质》选考题]现代世界产量最高的金属是Fe、Al、Cu.
(1)Fe、Al、Cu三种元素第一电离能由高到低的排序为 ;Fe2+的电子排布式为 。
(2)Cu(OH)2溶于浓氨水形成 色铜氨溶液;乙二酸( )分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
)分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
(3)以下变化伴随化学键破坏的是 (填下列选项标号)
| A.冰融化 | B.铝气化 | C.AlCl3溶于水 | D.胆矾受热变白 |
(4)二氧化硅晶体结构示意图如下,每个氧原子最近且等距离相邻 个氧原子。