(10分)X、Y、Z、W、V为前四周期常见的五种元素,其中四种为短周期元素。X原子核外电子数等于其电子层数;常温常压下,Y单质固体难溶于水而易溶于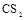 ;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
请回答下列问题:
(1)写出实验室通过加热制备Z单质的离子方程式 ;
(2)W的两种常见氧化物中阳离子和阴离子个数比为2:1的是
(写化学式);
(3)写出X、Y、W三种元素组成的化合物的水溶液与Z单质反应的离子方程式 (可不配平);
(4)检验V的最高价简单离子常用的试剂是 ;
(5)将12gY单质完全燃烧的产物通入1OOmL1.2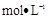 的氢氧化钠溶液中,所得溶液
的氢氧化钠溶液中,所得溶液
中含有的主要离子分别是
降冰片烯的分子结构如图:
(1)降冰片烯的分子式为________.
(2)降冰片烯分子中含有的官能团为________(写名称).
(3)降冰片烯属于________(填序号).
A.环状化合物 B.芳香化合物 C.链状化合物
根据下列有机化合物填空.
(1)①可以看作醇类的是________(填写序号,下同);
②可以看作酚类的是________;
③可以看作羧酸类的是________;
④可以看作酯类的是________.
(2)请写出b中所含官能团的结构简式________.
按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上.
(1)CH3CH2CH2COOH _________________________________;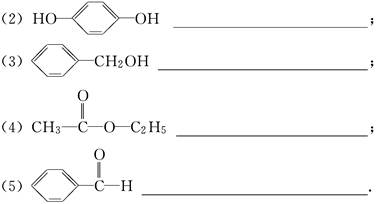
分析下列有机物的结构简式,指出它们分别含有哪些官能团,写出这些官能团的结构简式及名称: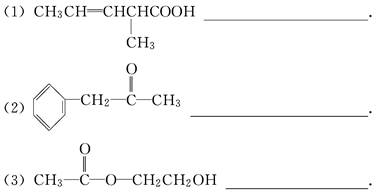
在下列化合物中:①CH3—CH3、②CH3CH===CH2、

属于环状化合物的是______,属于脂环化合物的是______,属于芳香化合物的是______,属于芳香烃的是________,属于脂肪烃的是________.