根据下列有机化合物填空.
(1)①可以看作醇类的是________(填写序号,下同);
②可以看作酚类的是________;
③可以看作羧酸类的是________;
④可以看作酯类的是________.
(2)请写出b中所含官能团的结构简式________.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。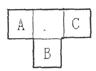
(1)写出A、B、C三种元素的名称__________、__________、__________。
(2)B元素位于元素周期表中第__________周期,第_________族。
(3)C的原子结构示意图为____________________,用电子式表示C的单质与H2反应的过程:__________________________________。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有_____________。
现有甲、乙、丙、丁四种短周期元素,甲元素M电子层上的电子数是K电子层上电子数的一半,乙元素的单质在室温下,冷的浓硫酸或空气中表面都能生成致密的氧化膜;丙元素的单质在常温下是黄绿色气体;丁元素的二价阴离子与丙元素的阴离子具有相同的电子层结构。
(1)写出甲、乙、丙、丁四种元素的符号。
甲_________、乙_________、丙__________、丁__________。
(2)甲元素和乙元素最高价氧化物对应的水化物碱性较强的是__________(填化学式)。
(3)将过量的丙元素的单质通入FeBr2溶液中,发生反应的离子方程式是:___________________________,该反应的氧化剂是:_______________(写物质名称)。
下表是元素周期表的一部分,请回答有关问题:
| IA |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
|||
| 1 |
a |
b |
||||||||
| 2 |
c |
d |
e |
f |
g |
|||||
| 3 |
h |
i |
j |
k |
l |
|||||
| 4 |
m |
n |
||||||||
(1)h元素与k元素形成的化合物的电子式:_____________________;
(2)f元素与n元素两者核电荷数之差是_____________________;
(3)属于稀有气体的是__________(填元素符号,下同);
(4)第三周期中,原子半径最大的是(稀有气体除外)________________;
(5)推测Si、N最简单氢化物的稳定性__________大于_________(填化学式)。
(6)表中标字母的元素中,能形成两性氢氧化物的元素是_____________________(用元素符号表示,下同),写出该两性氢氧化物与h的氢氧化物的水溶液反应的离子方程式____________________________________________;
(7)c2a4与n的单质反应的化学方程式____________________________________;
(8)写出c5a12的所有同分异构体的结构简式________________________________。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度/℃ |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
| A.Ba(OH)2溶液 | B.BaCl2溶液 |
| C.NaOH溶液 | D.澄清的石灰水 |
(2)将加热后的溶液冷却到10℃,若溶液的pH________8.3(填“大于”“小于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。
(13分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X微粒含有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。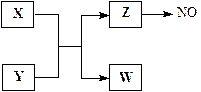
(1)Z →NO反应的化学方程式是:
液态 Z的电离与水的电离相似,电离生成电子数相同的两种微粒,写出液态Z的电离方程式。
(2)实验室中检验Z的化学试剂及现象是:
| 化学试剂 |
现象 |
|
| 方法一 |
||
| 方法二 |
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2︰4︰3,该离子化合物是(填写化学式),其0.1 mol/L的该溶液显酸性,则该溶液中离子浓度由大到小的顺序为。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气两者的体积比是: