实验室用需配制250mL0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
| |
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _____;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是
溶液注入容量瓶前需恢复到室温,这是因为_______________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为I A,通电时间为t min后,精确测得电极上析出铜的质量为m g。
试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接,C接,接F。
(2)写出B电极上发生的电极反应式:;
G试管中淀粉KI溶液变化的现象为,
相应的离子方程式是。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是。(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA=。
某学生为探究钠与CO2的反应,利用如下装置进行实验。(已知PdCl2能被CO还原得到黑色的Pd)。可供选择的药品有:CaCO3(块状)、Na2CO3(粉末)、盐酸、稀硫酸、钠。
(1)请将上图各装置连接完整:②→ →→①→。(填装置序号)
(2)写出装置②中反应的离子方程式:。
(3)检查装置气密性并装好药品后,当观察到现象时再点燃酒精灯;装置④的作用是。
(4)已知CO在潮湿环境中可将PdCl2还原为黑色粉末状的钯(Pd),写出该反应的化学方程式。
(5)实验过程中CO2足量,装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中反应后固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体。据此现象写出Na与CO2反应的化学方程式:。
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL 0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙⑤量筒 ⑥容量瓶 ⑦托盘天平 。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时还欠缺的仪器是。
(2)经计算,需浓H2SO4的体积为mL(精确到0.1)。
(3)配制过程有以下操作:
A.移液
B.量取
C.洗涤
D.定容
E.稀释
F.摇匀
其正确的操作顺序应是(填序号)。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有(填代号)。
A、定容时,俯视标线
B、稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
C、摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
D、转移前,容量瓶中含有少量蒸馏水
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)=。
(8分)准确称取12 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示: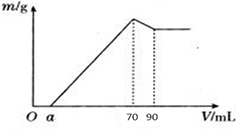
请填空回答:
(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=4.6,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各成分的质量分数:Al2O3为______________, SiO2为______________。
(17分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:。装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入。
| a |
b |
c |
d |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:。
(5)如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气0.06 mol。(填“大于”“小于”“等于”),若有17.4 g的MnO2被还原,则被氧化的HCl的质量为。