(共12分)物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。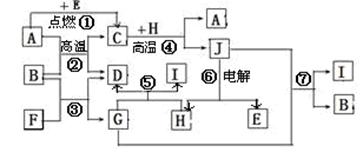
试回答下列有关问题:
(1)A在元素周期表的位置 周期 族。
(2)分别写出反应②⑦的化学方程式 ; 。
(3)写出引发反应④的实验操作 ;
(4)写出用A与H作电极材料插入G溶液形成闭合电路后的负极反应式是:
。
(5)写出上图中物质C与稀HNO3溶液反应的离子方程式: 。
某主族元素R的最高正化合价与最低负化合价的代数和为6,由此可以判断
| A.R可能是第二周期元素 |
| B.R一定是ⅥA族元素 |
| C.R的气态氢化物比同周期其它元素气态氢化物稳定 |
| D.R气态氢化物化学式为H2R |
下列物质中,既有离子键又有共价键的是
| A.CaCl2 | B.KOH | C.H2O | D.H2SO4 |
不能说明氧元素比硫元素非金属性强的事实是
| A.热稳定性H2O比H2S强 |
| B.H2S水溶液在空气中变浑浊 |
| C.H2O比H2S的沸点高 |
| D.在一定条件下,O2与Cu反应生成CuO,S与Cu反应生成Cu2S |
元素性质呈周期性变化的根本原因是
| A.核外电子排布呈周期性变化 | B.元素的相对原子质量逐渐增大 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
在某无色溶液中,加入盐酸酸化的BaCl2溶液有白色沉淀,则下列判断正确的是
| A.一定有SO42- | B.可能有SO42-或Ag+ |
| C.一定有Ag+ | D.可能有SO32-或SO42- |