(共14分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取及其相关实验的探究,回答下列问题.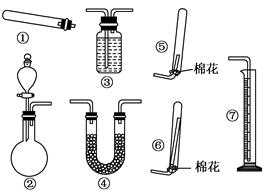
(1)若用装置①制取NH3,其反应的化学方程式为 ;若要测定生成的NH3的体积,则必须选择的装置是 (填装置序号),装置中所盛试剂应具有的性质是 .
(2)若用装置②制取并收集干燥的NH3,收集装置应选择 (填装置序号).
(3)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1—10nm之间)。
①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的离子方程式 ;
②在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_____________________________。
在下图中,横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量:
从A~D中选择符合表中各项要求填入相应位置。

实验室中可以用下列一些装置连接起来制纯净的CO2气体,并测定其分子量(用含少量FeS的大理石和盐酸制备CO2气体)。
实验步骤如下:
(1)将橡皮塞B塞在A烧瓶上,并用皮筋套在烧瓶的瓶劲处以标记橡皮塞入瓶颈的深度,准确称量其质量为w1。
(2)连接制取和净化气体的装置,其连接顺序是:_____接______,______接_____,_____接_____,______接______。
(3)将导管G插入烧瓶A中用向_____(上/下)排气法收集CO2并检验CO2是否已经充满,检验CO2已充满的方法是______,用橡皮塞塞好烧瓶瓶口称其质量为w2。
(4)将烧瓶口瓶塞取下向烧瓶注水至标记线,再将水倒入量筒测量水的体积为VmL。
(5)记录当时实验时室温为t℃和压强为p帕。(R取8.314Pa·L·K-1·mol-1)
回答下列问题:
①计算CO2分子量的算式是________。
②若不将气体净化,所测定的CO2分子量的数值将_____(偏高/偏低),其原因是_____。
某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
| 实验操作 |
实验现象 |
|
| 步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
| 步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
| 步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是;为达到该实验目的,还可以采取的方法是。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:。
要使含Ba2+,Al3+,Fe3+,Ag+的硝酸盐溶液进行分离,并制成各自离子的硝酸盐。今有人设计如下分离方法,请在下图中的空格内填写适当物质的化学式或离子符合,在题后填写各步所加试剂(供选用的试剂有:NaOH溶液、氨水、碳酸钠溶液、硝酸和葡萄糖溶液。)
①A______②B_____③C_____④D____⑤E______。
某无色溶液可能含有下列钠盐中的几种:
| A.氯化钠; | B.硫化钠; | C.亚硫酸钠; | D.硫代硫酸钠;(E)硫酸钠;(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清石灰水变浑浊,不能使品红溶液褪色。根据上述实验现象回答下列问题: |
(1)不能使品红试液褪色,说明该气体中不含_____(填化学式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母):
第一种情况是__________________________________;
第二种情况是__________________________________;
第三种情况是__________________________________;
第四种情况是__________________________________。
(可不填满,也可补充)