下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O 
对实验现象的“解释或结论”正确的是( )
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl- |
某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是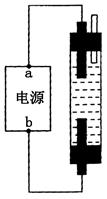
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极,b为阳极;HClO和NaCl |
在容积不变的密闭容器中发生反应2NO2 2NO+O2,能说明该反应已达化学平衡状态的是
2NO+O2,能说明该反应已达化学平衡状态的是
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③v(NO2)∶v(NO)∶v(O2)=2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的平均相对分子质量不再改变
| A.①④⑥ | B.②③⑤ | C.①③④ | D.④⑤⑥ |
下列有关水的电离的说法正确的是
| A.将水加热,KW增大,pH不变 |
| B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大 |
| C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小 |
| D.向水中加入少量NaOH固体,恢复到原温度,水的电离被抑制,[OH-]增大 |
有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
A.D>C>A>BB.D>A>B>CC.D>B>A>CD.B>A>D>C
正常人胃液的pH在0.3~1.2之间,胃酸(一般以盐酸表示)多了需要治疗。某些用以治疗胃酸过多的药物中含MgCO3、NaHCO3,也有用酒石酸钠来治疗的。这说明
| A.碳酸、酒石酸都不是强酸 |
| B.对人而言,酒石酸是必需的营养品 |
| C.MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感 |
| D.酒石酸钠水解显酸性 |