已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1 mol H―H键断裂时吸收热量为
| A. 920 kJ | B.557 kJ | C. 436 kJ | D.188 kJ |
柳州的龙江河铬污染事故再一次令人触目惊心,环境保护刻不容缓。下列关于铬的一种原子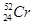 说法正确的是
说法正确的是
A.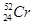 与 与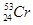 互为同素异形体 互为同素异形体 |
B.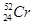 含有24个中子 含有24个中子 |
C.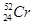 与 与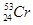 互为同位素,物理性质、化学性质均相同 互为同位素,物理性质、化学性质均相同 |
D.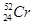 中子数比电子数多4个 中子数比电子数多4个 |
下列变化能够实现的是
①弱酸与盐溶液反应生成强酸②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性④复分解反应中既没有生成水,也没有生成沉淀和气体
| A.①③ | B.②④ | C.①②④ | D.①②③④ |
在室温时,下列各组中的物质分别与足量NaOH溶液反应,生成盐的种类最多的是
| A.Cl2、Al(NO3)3、SO2、SiO2 | B.CO、Al、NaHCO3、N2O5 |
| C.SiO2、NH4HCO3、SO3、CO2 | D.CaO、CO2、Cl2、NH4Al(SO4)2 |
用NA表示阿伏加德罗常数,下列说法错误的是:
| A.1mol C2H6分子中共含7NA个共价键 |
| B.25℃时,1mL纯水中含水10-10NA个OH-离子 |
| C.当NO2溶于水产生1molNO时,反应转移的电子数为2NA。 |
| D.标准状况下,22.4L三氧化硫所含的氧原子数等于3NA |
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是
| A.由二氧化碳合成金刚石是化学变化 | B.金刚石是碳的一种同位素 |
| C.钠被氧化最终生成碳酸钠 | D.金刚石中只含有非极性共价键 |