某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。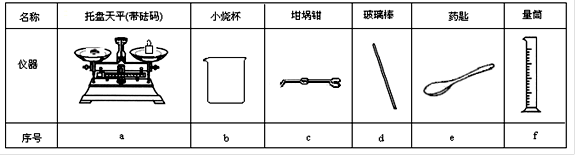
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如右图所示。
Ⅱ.中和热的测定:
(3)从实验过程来看,图中尚缺少的两种玻璃仪器是 __、________;
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: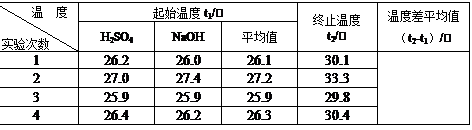
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c =" 4.18" J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.配制0.50 mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30 mL 0.50 mol/L的硫酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热的数值会 __________(填“相等”或“不相等”)。
(14分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。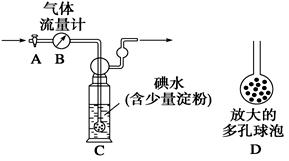
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式_______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是________________________________
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为__________________________(用含有V、m的代数式表示)。
(12分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。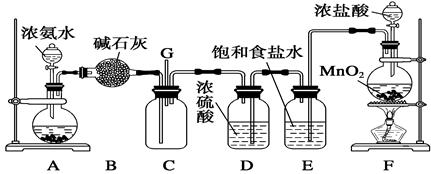
请回答下列问题:
(1)装置F中发生反应的离子方程式为____________________________________________。
(2) B装置的名称是___________________;E装置的作用___________________________。
(3)通入C装置的两根导管左边较长、右边较短,目的是____________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__________________________________________________。
(16分)用98%的浓硫酸(其密度为1.84g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,
(1)经计算,应用(填仪器名称及规格,下同)取浓硫酸。
(2)配制操作可分解成如下几步,以下正确的操作顺序是_____________________________
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需 __________、 __________。
(4)玻璃棒在整个实验中的作用是、。
(5)由于错误操作, 使得到的浓度数据比正确的偏大的是___________________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配 好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
(7分)(1)写出下图中序 号①~④仪器的名称:
号①~④仪器的名称: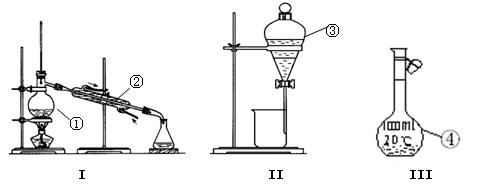
①;②;③;④;
(2)仪器①~④中,使用时必须检查是否漏水的有。(填仪器序号)
(3)分离碘水中的碘应选择装置II进行和操作(填操作名称)。
(6分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液法 B、加热分解C、结晶法D、分液法E、蒸馏法F、过滤法
(1)分离饱和食盐水和沙子的混合物;
(2)分离水和苯的混合物;
(3)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶。