如图所示的实验操作中正确的是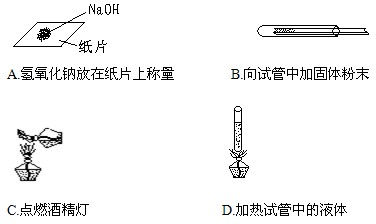
下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
| 选项 |
微粒组 |
所加试剂 |
离子方程式 |
| A |
NH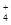 、Fe2+、SO 、Fe2+、SO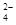 |
少量Ba(OH)2溶液 |
2NH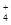 + 2NH + 2NH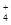 +SO +SO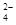 +Ba2++2OH- +Ba2++2OH-→ BaSO4↓+2NH3·H2O |
| B |
Mg2+、HCO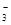 、Cl- 、Cl- |
过量NaOH溶液 |
Mg2++2HCO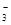 +4OH- +4OH-→ Mg(OH)2↓+2CO 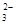 +2H2O +2H2O |
| C |
Fe2+、NO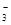 、HSO 、HSO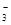 |
NaHSO4溶液 |
HSO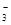 +H+→ SO2↑+H2O +H+→ SO2↑+H2O |
| D |
K+、NH3·H2O、CO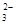 |
通入少量CO2 |
2NH3·H2O+CO2 → 2NH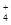 +CO +CO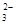 |
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
有关说法错误的是
| A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O → NaHCO3↓ + NH4Cl |
| B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 |
| C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 |
| D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
某种氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量是 |
B.m g该氯原子的物质的量是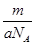 mol mol |
| C.该氯原子的摩尔质量是a NA g/mol | D.a g该氯原子所含质子数是17NA |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得 |
固体的质量为72g
现有下列两套实验装置,用于实验室制取乙酸乙酯或乙酸丁酯。下列说法错误的是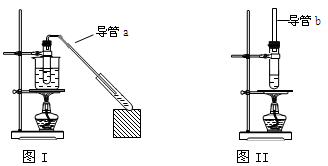
| A.图I装置用于制取乙酸乙酯,图II 装置用于制取乙酸丁酯 |
| B.导管a和导管b的作用都是冷凝回流 |
| C.都可用饱和Na2CO3溶液来洗去酯中的酸和醇 |
| D.加入过量的乙酸可以提高醇的转化率 |