今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是( )
| A.依据电荷守恒,推测一定存在K+和NH4+ |
| B.100mL溶液中含0.01mol CO32- |
| C.Ba2+一定不存在,Mg2+可能存在 |
| D.2.33g沉淀中含BaCO3和BaSO4 |
下列各溶液中,微粒的物质的量浓度关系正确的是
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c( Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
电解质溶液有许多奇妙之处,你只有深入的去思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类相同 |
| B.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者大于后者 |
| D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸 |
下列叙述错误的是
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液  混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) 混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) |
| B.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba2+)>c (Na+)> c (H+) |
| C.向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 |
| D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
已知反应:2SO2(g)+O2(g)  2
2 SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是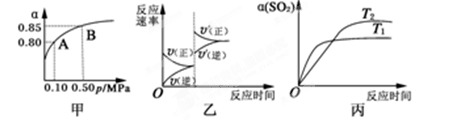
| A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1 |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 |
| C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0. 2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)