类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是( )
| A.“由Cl2+H2O===HCl+HClO”反应可推出“F2+H2O===HF+HFO”反应也能发生 |
| B.HCl的水溶液是强酸,推出HF的水溶液也是强酸 |
| C.由“2Fe+3Cl2===2FeCl3”反应可推出“2Fe+3I2===2FeI3”反应也能发生 |
| D.Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
关于化学平衡常数,下列说法不正确的是( )
| A.化学平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.化学平衡常数随温度的改变而改变 |
| C.对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1 |
| D.温度越高,K值越大 |
某原电池总反应离子方程式为2Fe3+ + Fe=3Fe2+,不能实现该反应的原电池是( )
| A.正极Cu,负极Fe,电解质为FeCl3溶液 |
| B.正极为C,负极为Fe,电解质为Fe(NO3)3溶液 |
| C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质为CuSO4溶液 |
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)  4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是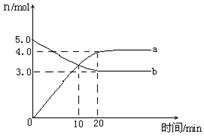
| A.10min时,反应达到平衡 |
| B.该温度下反应的平衡常数为8 |
| C.0~20min内平均反应速率v(N2O5)=0.05mol∙L-1∙min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
对于常温下pH为3的NH4Cl溶液,下列叙述不正确的是
| A.c(H+) + c(NH4+)= c(Cl-)+ c(OH-) |
| B.c(Cl-)> c(NH4+)> c(OH-)> c(H+) |
| C.升高温度NH4+ 浓度变小 |
| D.加入少量NaOH溶液后,n(NH3·H2O)变小 |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等,则
| A.原子半径:丙>丁>乙 |
| B.甲的气态氢化物的水溶液呈酸性 |
| C.丙与乙形成的化合物具有两性 |
| D.同周期元素中丁的最高价氧化物对应的水化物的酸性最强 |