地球的海水总量约有1.4×1018t,是人类最大的资源库。
(1)如右图利用海水得到淡水的方法为 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如右下图。a是电源的 极;Ⅰ口排出的是 (填“淡水” 或“浓水”)。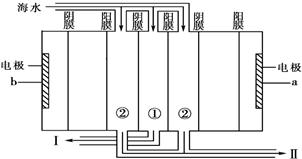
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、 Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、 BaCl2、Na2CO3等),其中HCl的作用主要是
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为:___________________________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:________________________。
(5)离子交换树脂法是制备纯水(去离子水)的主要方法。某阳离子交换树酯的局部结构可写成(右图)。该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经__ 反应得到的。自来水与该离子交换树脂交换作用后显 (填“酸性”、“碱性”或“中性”)。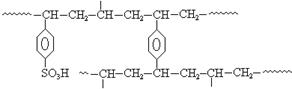
(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大。如果硬度过大,饮用后对人体健康与日常生活有一定影响。暂时硬水的硬度是由 (填阴离子符号)引起的,经 (填操作名称)后可被去掉。永久硬水的硬度可由离子交换法去掉。
化学是一门以实验为基础的自然科学,右图为某试剂瓶上的标签,试回答下列问题。
(1)该盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中随所取体积的多少而变化的是________。
| A.溶液中HCl的物质的量 |
| B.溶液的浓度 |
| C.溶液中Cl-的数目 |
| D.溶液的密度 |
(3)某学生欲用上述较浓盐酸和蒸馏水配制500 mL物质的量浓度为0.150 mol·L-1的稀盐酸。
①该学生需要量取________mL上述较浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏小”,填B表示“偏大”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面( )。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )。
c.配溶液用的容量瓶用蒸馏水洗涤后未经干燥( )。
化学实验是学习化学的基础,要通过实验去学习化学。
(1)下列关于实验的叙述中正确的有________。
| A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 |
| B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
| C.用托盘天平称量物品质量时,物品应置于右盘 |
| D.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
E.可燃性气体点燃前一定要验纯
F.使用分液漏斗前必须检查其是否漏水
(2)请将下列错误实验操作可能会引起的不良后果填在表格中。
| 实验 |
向试管中加锌粒 |
对量筒中液体读数 |
浓硫酸的稀释 |
| 错误操作 |
 |
 |
 |
| 不良后果 |
如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:A(g)+3B(g)  2C(g)+D(s) ΔH<0
2C(g)+D(s) ΔH<0
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是 。
A.混合气体的总质量不随时间改变
B.2 v正(C) = 3v逆(B)
C.A、B转化率相等
D.物质D的质量不随时间改变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时甲容器的体积为_______mL。
(3)当甲乙两容器中反应都达平衡时,甲和乙中B的转化率α甲(B) _________α乙(B)。(填“>”“<”或“=”)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n(D)应该满足的条件为______________。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A的名称是______,B的名称是______, C的化学式为______。反应的化学方程式分别为: , 。
(1)相同物质的量的O2和O3的质量比________,分子个数比为_______,所含氧原子的个数比为_____。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为______。此溶液中Mg2+的物质的量浓度为________,Cl-的物质的量浓度为___________________。