化学是一门以实验为基础的自然科学,右图为某试剂瓶上的标签,试回答下列问题。

(1)该盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中随所取体积的多少而变化的是________。
| A.溶液中HCl的物质的量 |
| B.溶液的浓度 |
| C.溶液中Cl-的数目 |
| D.溶液的密度 |
(3)某学生欲用上述较浓盐酸和蒸馏水配制500 mL物质的量浓度为0.150 mol·L-1的稀盐酸。
①该学生需要量取________mL上述较浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏小”,填B表示“偏大”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面( )。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )。
c.配溶液用的容量瓶用蒸馏水洗涤后未经干燥( )。
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P 4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为_______________。
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能:P—P 198 kJ·mol-1,Cl—Cl 243 kJ·mol-1,P—Cl 331 kJ·mol-1。则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。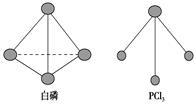
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:
分析上述实验,回答下列问题:
(1)实验2中电流由________极流向________极(填“A”或“B”)。
(2)实验6中电子由B极流向A极,表明负极是__________(填“镁”或“铝”)电极。
(3)实验5表明____________。
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________。
A.相对活泼的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属导体)
Cl2及其化合物在生产、生活中具有广泛的用途。
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________;
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为__________________。
(2)①ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式________ ;
②工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,生成ClO3–的电极反应式为 。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号);
②B → A + D反应的热化学方程式为 (用离子符号表示)。
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应可能发生的是 。
A.NH4NO3 → N2 + O2 + H2O B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN + H2O2 — N2↑+ X + H2O
推测X的化学式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e : f的值为 (填选项标号)。
A.1B.1/2 C.2D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:______________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示: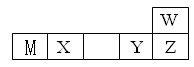
其中只有M为金属元素,请回答下列问题:
(1)M在元素周期表中的位置为 ,比较Y与Z两种元素的简单离子的半径大小 (用离子符号表示)。
(2)写出X的氧化物与W的氢化物的水溶液反应的化学方程式 。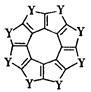
(3)科学家研制出一种新型分子C16Y8(结构如图所示)它将成为潜在的储氢材料。1molC16Y8最多能与 molH2发生加成反应。
(4)一种名贵黄石组成为M2(XO4)WOH,在强碱性溶液中会发生腐蚀,写出其过量NaOH溶液反应的化学方程式 。