已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是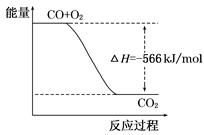
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO2(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
下列事实不能用勒夏特列原理解释的是()
| A.配制FeSO4溶液时在溶液中加入稀硫酸 |
| B.温度控制在450℃有利于二氧化硫的催化氧化 |
| C.增大压强有利于合成氨反应 |
D.工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 |
下列实验中所选用的仪器合理的是()
| A.用100mL量筒量取5.2mL稀硫酸 |
| B.用碱式滴定管量取20.10mL溴水 |
| C.用托盘天平称取8.56g食盐 |
| D.用250mL容量瓶配制230mL0.2 mol·L-1的氢氧化钠溶液 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3溶液 ⑥KCl溶液,其中正确的组合是()
| A.②④⑥ | B.①②③ | C.②③⑤ | D.②④⑤ |
下列叙述正确的是()
| A.HCl和NaOH反应的中和热为ΔH=–57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为ΔH=2×(–57.3)kJ/mol |
| B.CO(g)燃烧热ΔH=–283.0kJ/mol,则2CO2(g) =" 2CO(g)" + O2(g)反应的ΔH=+2×283.0kJ/mol |
| C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是()
| A.正极反应式:Ag+Cl--e-= AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |