已知醋酸是日常生活中常见的弱酸。
(1)用pH试纸测定醋酸pH的操作是___________。
(2)常温下在 pH =5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是______ mol•L—1。
(3)用0.1000 mol•L—1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处 (填序号)。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器___________________。
(4)某次滴定前滴定管液面如图所示,读数为________mL。

(5)根据正确实验结果所绘制的滴定曲线如上图所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离平衡常数___________,CH3COOH的物质的量浓度为__________ mol•L—1。
(共14分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应。
(2)甲和乙两个水浴作用不相同。甲的作用是;
乙的作用是。
(3)反应进行一段时间后,干燥管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可现在混合液中加入 (填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过(填试验操作名称)即可除去。
某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
【猜想】(1)甲同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液,而不能用澄清石灰水鉴别。
(2)乙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别。
依据是。
(3)丙同学认为可用盐酸鉴别Na2CO3和NaHCO3固体。
【实验探究】
(1)甲同学:①将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现盛有Na2CO3的试管产生了白色沉淀;②将澄清石灰水加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀。
此实验结果与猜想相同。
(2)乙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,乙同学观察到实验现象与①不同,证实了自己的猜想是合理的。
(3)丙同学在两支分别盛有少量Na2CO3、NaHCO3固体的试管中,各加入2 mL
2 mol/L的盐酸,观察到两支试管中均产生了大量气体,实验结果与猜想不一致,即得出不能用盐酸鉴别Na2CO3和NaHCO3。
【问题讨论】
(1)甲同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,该反应的离子方程式为;
(2)乙同学在加热Na2CO3固体时,开始产生少量气泡的原因是;在加热NaHCO3固体时,乙同学观察到的实验现象是。
(3)丁同学认为丙同学的结论不对。丁同学认为对实验方案做一些改进,可用于鉴别碳酸钠与碳酸氢钠。他的改进方法是:称取各2.1 g两种固体,放入两个容积一样的气球中,在两只锥形瓶中各加入约25 mL 2 mol/L 的盐酸,分别将气球套在锥形瓶瓶口上,同时将气球中的固体同时倒入锥形瓶中,气球的膨胀比较(填快或慢)的或最后气球比较(填大或小)的是碳酸氢钠。
【拓展应用】
(1)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的溶液。
(2)要测定Na2CO3与NaHCO3固体混合物中Na2CO3的质量分数,可采用的方案有多种,请简述其中一种方案(写出简要步骤及要测定的数据,不要求写出如何用数据求出结果):
。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用(选填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)B装置的作用;
E装置的作用;
D装置的作用。
(3)通入C装置的两根导管左边较长、右边较短,目的是。
(4)装置F中发生反应的化学方程式是。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
如图,在试管a中先加入3mL95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2ml醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
(1)用化学方程式表示反应原理___________________________
(2)加入浓H2SO4的作用是_______________________
(3)试管b中观察到的主要现象是_____________________________
(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用是 _____________________。
(5)饱和Na2CO3溶液的作用是______________________________
。
某实验小组向溴水中加入足量的乙醛,发现溴水褪色。该实验小组对反应产物进行探究。
(1)提出假设
①乙醛与溴水发生加成反应生成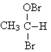
②乙醛与溴水发生取代反应生成CH2BrCHO;
③乙醛与溴水发生氧化反应生成 A。
(2)基于假设③设计实验方案证明你的假设(不要在答题卡上作答)
(3)实验过程
根据(2)的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。(限选实验仪器与试剂:试管、玻璃棒、滴管、酒精灯、铁架台、导管、胶塞、乙醇、浓硫酸、饱和碳酸钠溶液、氢氧化钠溶液。)
| 实验操作 |
预期现象与结论 |
| 步骤1:取一定量 B于试管中,然后边震荡试管边慢慢加入适量 C和 D。 |
|
| 步骤2:固定好装置,用酒精灯缓慢加热。将产生的蒸气通到 E溶液的液面上。 |
F, G。 |
(4)反思与评价:①有同学认为直接用pH试纸检验反应后溶液的pH大小即可验证反应产物,你认为是否合理: H(填合理或不合理)。原因是 I。
②乙醛被溴水氧化的反应方程式是 K。