在如下图所示的物质转化关系中,A是一种固体单质,E是一种白色不溶物,请完成下列问题:
(1)B的化学式为___________,目前B已被用作_____________________的主要原料。
(2)B和a溶液反应的离子方程式:________________________________________________。
(3)A和a溶液反应的离子方程式:_____________________________________________。
(4)C和过量盐酸反应的离子方程式:___________________________________________。
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL的容量瓶中定容配成250 mL烧碱溶液 |
| B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读 数为V1 数为V1 |
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是→ → →D→(均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________。
(4)D步骤中液面应调节到________________________________________________________________________,尖嘴部分应_____________________________________________________________。
(5)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是
________________________________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_________ ______________________________________。
______________________________________。
(1)下图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是_(填代号)。
①亚硫酸钠和硫酸②二氧化锰和浓盐酸③浓氨水和生石灰④石灰石和稀硫酸⑤锌和稀硫酸⑥硫化亚铁与稀硫酸⑦双氧水和二氧化锰
(2)有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是_______(填代号)。
| A.氢氧化钠溶液 | B.甲基橙溶液 | C.稀盐酸 | D.澄清石灰水 |
②除上述方法外,你认为是否还有其它的方法,具体如何操作_______。
(3)实验室需要用纯净的NaCl溶液,现有的NaCl晶体中混有少量的Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微热好?你选择的是,其理由是
。
②以下是除去SO42-的实验方案。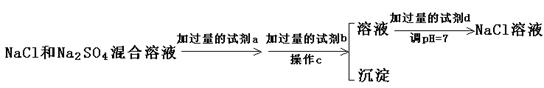
过量的a试剂是,C操作中所使用的玻璃仪器的名称是,证明SO42-已经沉淀完全的方法是 。
。
某同学取一定量淀粉进行水解实验,其实验步骤如下所示:
请回答下列问题:
①所加入的试剂分别是
A________,B________,C________;
②加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
(10分)为回收和利用废旧塑料减轻“白色污染”,某兴趣小组进行如下探究:
<实验课题>废旧聚丙烯塑料热分解主要产物为烃的探究
<查阅资料>
①废旧聚丙烯塑料热分解的产物为常温下的气态烃和液态烃,且不含一氧化碳和氢气
②CuO能将烃氧化成CO2和H2O
③甲苯可被酸性KMnO4溶液氧化为苯甲酸,苯甲酸能溶于苯
<实验设计>
<实验记录>
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E中黑色氧化铜变红;④F中无水硫酸铜变蓝。
<问题讨论>
请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物。若要将两者分离,其实验方法是;若要除去混合物中的甲苯,其方法是向混合物中加入足量酸性KMnO4溶液,充分反应后,再加入一定量的NaOH溶液,充分反应,再。
(2)C装置的作用是;如果没有D装置,对实验结论产生的影响是。
(3)若需验证聚丙烯塑料热分解产物中确含气态烃,还需在F装置后增加一个实验装置,请将增加的装置图(要注明其中盛放的试剂名称)画在“实验设计”栏中的空白方框内。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
(1)实验操作③的名称是___________,所用主要仪器名称为______________________。
(2)提取碘的过程中,可选择的试剂是________________(已知碘的沸点为184.40C)。
A.酒精(沸点780C) B.四氯化碳(沸点770C)
C.甘油(沸点1900C) D.苯(沸点800C)
(3)操作②的离子方程式为;该步骤的含I2溶液中生成有少量ICl,为使碘全部以单质形式游离出来,应加入适量KI溶液,此反应的化学方程式为。