如图所示,夹子开始处于关闭状态,将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是( )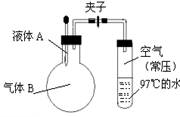
| A.水、氯化氢 | B.硫酸、氨气 |
| C.氢氧化钠溶液、二氧化硫 | D.氢氧化钠溶液、一氧化碳 |
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O
2Ag↓+CH3COONH4+3NH3+H2O
③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
下列化合物的分子中,所有原子都处于同一平面的有
| A.乙烷 | B.甲苯 | C.六氯苯 | D.聚氯乙烯 |
下列化合物中,在常温常压下以液态形式存在的是
| A.CH3OH | B.CH2O | C.CH3Cl | D.C4H10 |
下列与有机物有关的化学用语不恰当的是
禁止使用工业酒精配制料酒,这是因为工业酒精中常含有少量会使人中毒的
| A.乙酸 | B.甲醇 | C.乙醛 | D.苯酚 |