根据水泥、玻璃和陶瓷的生产过程,总结出硅酸盐工业的一般特点是( )
①原料一定是含硅元素的物质 ②生成物是硅酸盐 ③反应条件是高温 ④发生复杂的物理、化学变化
| A.①和② | B.①②③ | C.①③④ | D.①②③④ |
如下图中的曲线表示在一定条件下,2NO+O2 2NO2(正反应为放热反应),反应中NO的转化率与温度的关系曲线,图中标出a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应),反应中NO的转化率与温度的关系曲线,图中标出a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
| A.a点 | B.b点 | C.c点 | D.d点 |
将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
| A.混合气体的密度 |
| B.混合气体的压强 |
| C.混合气体的平均相对分子质量 |
| D.混合气体的总物质的量 |
.将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s) NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g) H2(g)+I2(g)。当反应达到平衡时,c(H2)="0.5" mol·L-1,c(HI)="4" mol·L-1,则NH3的浓度为( )
H2(g)+I2(g)。当反应达到平衡时,c(H2)="0.5" mol·L-1,c(HI)="4" mol·L-1,则NH3的浓度为( )
| A.3.5 mol·L-1 | B.4 mol·L-1 |
| C.4.5 mol·L-1 | D.5 mol·L-1 |
密闭容器中进行如下反应:X2(g)+3Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是( )
| A.X2为0.4 mol·L-1,Y2为1.2 mol·L-1 |
| B.Y2为1.0 mol·L-1 |
| C.X2为0.3 mol·L-1,Z为0.2 mol·L-1 |
| D.Z为1.0 mol·L-1 |
X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z,达到平衡时若它们的物质的量满足:n(X)+n(Y)====n(Z),则Y的转化率为( )
2Z,达到平衡时若它们的物质的量满足:n(X)+n(Y)====n(Z),则Y的转化率为( )
A. ×100% ×100% |
B. ×100% ×100% |
C.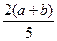 ×100% ×100% |
D. ×100% ×100% |