碘缺乏症遍及全球,多发于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有100万人左右。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一( )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患( )
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾,反应的化学方程式为__________________,氧化产物与还原产物的物质的量之比为__________,能观察到的明显现象是___________________________________________________________。
(4)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应的化学方程式为:KI+3H2O KIO3+3H2↑,则两极反应式分别为:阳极_________________________,阴极__________________________。
KIO3+3H2↑,则两极反应式分别为:阳极_________________________,阴极__________________________。
(5)在某温度下,若以12 A的电流强度电解KI溶液10min,理论上可得标况下氢气________L。
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是(填编号)。写出 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________;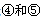 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为(用对应的元素符号表示)。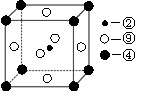
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是。
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的价电子数为; 该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。
请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测ab(填“大于”、“小于”、“等于”),理由是
| 元素 |
Mn |
F |
|
| 电离能 (  ) ) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
a |
b |
(4)AC2分子中σ键和π键数目比为;
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
②熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:
CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
X属于晶体(填晶体类型)。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有个。
②石墨晶体能导电,导电的粒子是。
(3)甲硅烷(SiH4)的结构与甲烷相似,甲硅烷能与硝酸银发生如下反应:
SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断电负性:SiH(填“>”、“<”或“=”)
(6分)现有下列物质, 用编号填空回答下列各问:
| A.干冰 | B.金刚石 | C.氩 | D.晶体硅 |
E.过氧化钠 F.二氧化硅,G. 溴化铵
(1)通过非极性键形成的晶体是___________。
(2)固态时属于不含化学键的分子晶体是________。
(3)含有极性键的分子晶体是。
(4)由极性共价键形成的晶体是 _______。
(5)含有非极性键的离子化合物是。
(6)含有离子键、共价键、配位键的化合物是。
怎样用化学方法除去下列物质中混有的少量杂质,写出有关反应的离子方程式。
(1)铜粉中混有铁粉
(2)铁粉中混有铝粉
(3)FeCl2溶液中混有FeCl3
(4)FeCl2溶液中混有CuCl2
(5)FeCl3溶液中混有FeCl2