(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。写出 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________;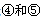 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。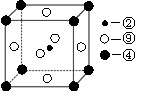
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的价电子数为 ; 该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(10分)维生素C(分子式为C6H8O6)又名抗坏血酸,可预防感染、坏血病等,也是一种常见的食品添加剂,能够阻止空气中的氧气将食品氧化变质。维生素C具有酸性和强还原性,其工业合成路线如下图所示:
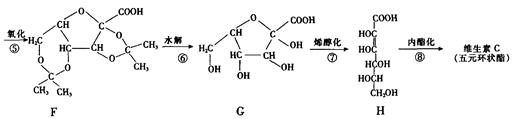
(1)上述合成过程中与A互为同分异构体的有(填写字母代号)。
(2)上述反应中,属于加成反应的有(填数字序号)。
(3)反应④除生成E外,还有生成。比较D和C的结构可知,C可看成由D通过反应⑤氧化得到,在工业生产中设计④和⑥两步的目的是
。
(4)维生素C的结构简式是。
(8分)由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。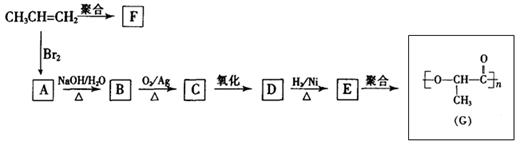
(1)聚合物F的结构简式是。
(2)D的结构简式是。
(3)B转化为C的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是。
(10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。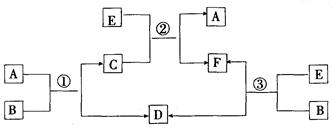
(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为,其中A的化学式是。
(2)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是
(3)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应①的离子方程式是。在反应③中,若生成1 molD,则转移电子数目为。
(8分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是(选填“A”或“D”);A和B的离子中,半径较小的是(填离子符号)。
(2)元素C在元素周期表中的位置是。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。该化合物的电子式是。
现在城市居民使用的管道煤气的主要成分是H2、CO和少量CH4。H2、CO和CH4的燃烧热数据如下表
| 物质 |
H2 |
CO |
CH4 |
| 燃烧热(kJ•mol-1) |
285.8 |
283.0 |
890.3 |
(1)请写出H2、CO和CH4燃烧的热化学方程式。
_________________________________________________;
_________________________________________________;
_________________________________________________。
(2)作为开发西部的西气东输工程的重要成就,西部天然气已全面进入上海、江苏境内,陆续成为城市居民使用的主要能源。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量或减少_____(填“空气”或“天然气”)的进入量。