由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”、“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度/mol·L-1 |
| |
|
| |
|
(3)试确定K+是否存在?________,判断的理由是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。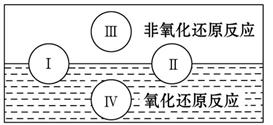
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________________,
其中水为_______剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
_____CuO+_____NH4Cl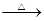 _____Cu+_____CuCl2+N2↑+_____H2O。
_____Cu+_____CuCl2+N2↑+_____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是_______(填元素名称),氧化剂是_______(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。每生成1 mol P4时,就有_______mol电子发生转移。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、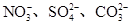 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是_________________________________________________;
所含的阴离子相同的两种盐的化学式是_____________________________________________。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示)________________。
(3)A和C的溶液反应的离子方程式是______________________________________________。
E和氨水反应的离子方程式是______________________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是__________________________________。
(1)含氯消毒剂可防甲型H1N1流感。二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。请写出反应的离子方程式_____________________________________________________________________________。
(2)某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有_______,一定不会含有大量的_______。
②该溶液与Al2O3反应后有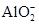 生成,则原溶液中一定含有_______,可能含有大量的_______。
生成,则原溶液中一定含有_______,可能含有大量的_______。
③写出该溶液与Al2O3反应生成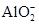 的离子方程式____________________________。
的离子方程式____________________________。
有以下物质:①液氨;②氨水;③盐酸;④醋酸;⑤硫酸钡;⑥银;⑦氯化钠晶体;⑧二氧化碳;⑨醋酸铵;⑩酒精溶液。
(1)属于电解质的是_____________________________________________________________;
(2)能导电的是_________________________________________________________________;
(3)属于强电解质的是___________________________________________________________。
取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为_________,反应后得到的FeCl3溶液呈黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可以观察到有红褐色沉淀生成,反应的化学方程式为________________________________________________,
此反应属于_________反应。
(2)在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
(3)另取一小烧杯也加入25 mL蒸馏水,向烧杯中也加入2 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处:分别用红色激光笔照射烧杯中的液体,在与光线垂直的角度,可以看到________烧杯中会产生丁达尔效应。用这个实验可以区别________________________________________________________________________。
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀盐酸,边滴边振荡,可以看到溶液红褐色逐渐变浅,最终又得到了黄色的FeCl3溶液,发生此变化的化学方程式为___________________________,此反应属于_________反应。