下列化学反应的热量变化可用:H+(aq) + OH-(aq) = H2O(l),△H= —57.2kJ/mol表示的是( )
| A.含有1molH2SO4的浓硫酸与含有1molNaOH的稀溶液混合 |
| B.0.1 mol/L 的醋酸溶液与 1mol/L的NaOH溶液等体积混合 |
| C.1mol/L的盐酸10mL与1mol/L的NaOH15mL混合 |
| D.1mol/L的盐酸10mL与1mol/L的氨水15mL混合 |
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是
A.NH4H的电子式为 |
B.NH4Cl的电子式为 |
| C.NH4H含有极性共价键和离子键 |
| D.NH4H固体投入少量热水中,有两种气体生成 |
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是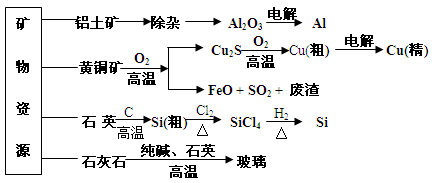
| A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO |
| B.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
| C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 |
| D.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
已知25℃时:①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH3<0
下列说法正确的是
| A.HF的电离方程式及热效应:HF(aq)===H+(aq)+F-(aq) ΔH>0 |
| B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 |
| C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 |
| D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+ 2H2O(l)ΔH=-114.6 kJ·mol-1 |
下列对各种平衡体系的叙述中,完全正确的一组是
①在醋酸溶液中存在的电离平衡:CH3COOH CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
②常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动;
③一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
④某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
⑤在上述④的可逆反应中,当容器中气体压强不变时,反应达到平衡;
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动;
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑥⑦ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
常温下,浓度均为0.l mol/L的下列四种盐溶液,其pH测定如下表所示:
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH 和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)