常温下,浓度均为0.l mol/L的下列四种盐溶液,其pH测定如下表所示:
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH 和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
提示:BaSO4(s) Ba2+(aq)+SO(aq)的平衡常数KSP=c(Ba2+)·c(SO ),称为溶度积常数。
Ba2+(aq)+SO(aq)的平衡常数KSP=c(Ba2+)·c(SO ),称为溶度积常数。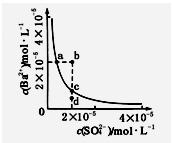
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的KSP大于c点对应的KSP |
可逆反应: 2NO2(g ) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ |
| C.①③④⑤ | D.全部 |
在0.lmol/L的HA溶液中存在如下电离平衡: HA A-+H+,对于该溶液,下列叙述正确的是( )
A-+H+,对于该溶液,下列叙述正确的是( )
| A.滴加少量0.lmol/L HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 |
| B.加水,溶液中所有离子浓度均减小 |
| C.加入少量NaA固体,平衡向逆反应方向移动, 溶液中c(OH-)增大 |
| D.加入少量NaOH固体,平衡向正反应方向移动, 溶液中c(H+)增大 |
在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应是( )
| A.0.01mol·L-1的CH3COOH与pH=12的NaOH溶液等体积混合 |
| B.0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合 |
| C.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7 |
| D.0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是()
| A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |