某原电池构造如下图所示。其电池的总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。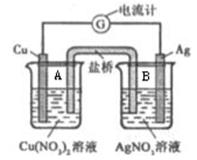
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是___________________________。OH-离子移向_______(填“A”或“B”)中的溶液。Cu为原电池的______极,其电极反应式是_____________________________。A中的电解质溶液在该电池工作一段时间后会出现_______________________的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。
为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g)∆H1="-566" kJ∙mol-1
②2NO(g)+2CO(g) ⇋ N2(g)+ 2CO2(g)∆H2="-746" kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_______________。
(5)氮氧化物进入水体可转化为NO3─,电化学降解法可用于治理水中NO3─的污染。原理如图所示。
电源正极为(填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的NO3─为g。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________。
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,需进行的实验是__________。
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为(简要表述计算过程)__________。
在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示: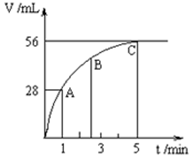
(1)该反应还可用____________代替二氧化锰做催化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序为_____________________。试解释反应速率变化的原因是___________________。
(3)该H2O2水溶液的物质的量浓度为____________________。
现有A、B、C三种烃,A是B分子中的所有氢原子被C的一价取代基(即烃分子失去一个氢原子后剩余的部分)取代的产物。
已知:
① A不能使溴的CCl4溶液褪色,其一氯代物只有一种。
② 一定量的B完全燃烧,将产物依次通过盛有CaCl2和碱石灰的干燥管,测得质量增重分别为3.6g和17.6g;且26g/mol<M(B)<78g/mol。
③ C为饱和链烃,通常情况下为气态,其同分异构体不超过2种,二溴代物有3种。
回答下列问题:
(1)B的最简式是_______,写出B的一种链状同分异构体的结构简式_________(要求:所有原子在同一平面内,所有碳原子不处于同一直线上)。
(2)C的分子式为_______,其一溴代物在氢氧化钠醇溶液和加热条件下可以发生反应,则反应后有机产物的名称为_______________。
(3)B分子的所有氢原子被硝基取代后的产物为一种新型炸药,该炸药爆炸分解产生无毒的物质,写出该爆炸反应的化学方程式__________________。
(1)请用下面的A-D字母填空:①由乙醇制乙烯;②乙醛的银镜反应:
| A.直接加热 | B.垫石棉网加热 | C.水浴加热 | D.不需要加热 |
(2)既不属于取代反应也不属于消去反应的有机反应是(反应条件未注明)____(填序号)
① Fe + 2HCl = FeCl2 + H2↑
② CH2=CHCH3 + Cl2 →CH2=CHCH2Cl + HCl
③ 2CH3CH2OH→CH3CH2OCH2CH3+ H2O
④ CH3CH2Br + NaOH→CH2=CH2+NaBr + H2O
⑤ 2CH3CHO + O2→CH3COOH + H2O
⑥
(3)按系统命名法:
① CH2=C(C2H5)(CH2)2CH(CH3)C(CH3)3的名称为___________________。
② CH3CH2CH2OH的名称为_________________。
(4)仔细观察下列有机物,该系列有机物中第n个分子的分子式为__________;二十八星烷中碳的百分含量为_______。