已知有如下反应:①2BrO3-+Cl2==Br2+2ClO3-,②ClO3-+5Cl-+6H+==3Cl2+3H2O,
③2FeCl3+2KI==2FeCl2+2KCl+I2,④2FeCl2+Cl2==2FeCl3。下列各微粒氧化能力由强到弱的顺序正确的是
| A.ClO3->BrO3->Cl2>Fe3+>I2 | B.BrO3->Cl2>ClO3->I2>Fe3+ |
| C.BrO3->ClO3->Cl2>Fe3+>I2 | D.BrO3->ClO3->Fe3+ >Cl2>I2 |
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是: 。
。
总反应式为: 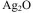
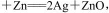 ,下列说法正确的是
,下列说法正确的是
| A.Zn为正极, Ag2O为负极 |
| B.电解质溶液中, OH-移向Ag2O极 |
| C.原电池工作时,正极区溶液pH值增大 |
| D.原电池工作时,负极区溶液pH值增大 |
相同物质的量浓度的NaCN和NaClO溶液相比,前者的pH较大,则下列有关同温、同体积和同浓度的HCN和HClO叙述中,正确的是
| A.酸性:HCN>HClO |
| B.浓度:c(CN-)<c(ClO-) |
| C.pH:HClO> HCN |
| D.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
由下列物质所配成的0.l mol  的溶液中,离子浓度由大到小的顺序正确的是
的溶液中,离子浓度由大到小的顺序正确的是
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
| B.醋酸的电离程度增大,c( H+)亦增大 |
| C.稀释后的溶液可消耗NaOH的物质的量不变 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1mol/L)至pH =7,消耗NaOH溶液的体积为 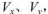 ,则
,则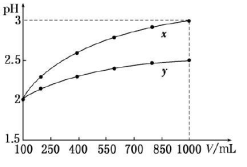
A.x为弱酸, |
B.y为弱酸, |
C.x为强酸, |
D.y为弱酸, |