根据碘与氢气反应的热化学方程式
(Ⅰ) H2(g)+I2(g) 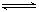 2HI(g) H="-9.48" kJ ▪mol-1
2HI(g) H="-9.48" kJ ▪mol-1
(Ⅱ) H2(g)+I2(s) 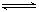 2HI(g) H="+26.48" kJ ▪mol-1
2HI(g) H="+26.48" kJ ▪mol-1
下列判断正确的是( )
| A.254 g I2(g)中通入2 g H2(g)反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 |
| D.反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低 |
下列不能用勒夏特列原理解释的事实是()
| A.棕红色的NO2加压后颜色先变深后变浅 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.黄绿色的氯水光照后颜色变浅 |
| D.合成氨工业使用高压以提高氨的产量 |
把3molP和2.5molQ置于2L密闭容器中发生如下反应:3P(g)+Q(g) xM(g)+2N(g)经5mim反应达平衡时,测知生成1molN,M的平均反应速率为0.1mol/(L.min),下列叙述错误的是
xM(g)+2N(g)经5mim反应达平衡时,测知生成1molN,M的平均反应速率为0.1mol/(L.min),下列叙述错误的是
| A.P的平均反应速率为0.15 mol/(L.min); |
| B.Q的转化率为25%; |
| C.Q的平衡浓度为1mol/L; |
| D.x的值是2。 |
N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
| A.N2(g)+3H2(g) = 2NH3(g) ;△H = 2(b—a) kJ/mol |
| B.N2(g)+3H2(g) = 2NH3(l);△H = 2(a—b—c) kJ/mol |
C. N2(g)+ N2(g)+ H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol |
D. N2(g)+ N2(g)+ H2(g) =NH3(g) ;△H = (a+b) kJ/mol H2(g) =NH3(g) ;△H = (a+b) kJ/mol |
下列说法或表示法正确的是( )
| A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)→C(金刚石) ΔH =" +1.9" kJ·mol—1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H++OH-=H2O ΔH = -57.3 kJ· mol—1,若将含1 mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)=2H2O(l) ΔH =" +285.8" kJ· mol—1 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2OΔH<0
2N2(g)+3H2OΔH<0
在恒容的密闭容器中,下列有关说法正确的是(
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1:2时,反应没有达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |