反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
| A.υ(NH3)=0.010mol/(L·s) | B.υ(O2)=0.0010mol/(L·s) |
| C.υ(NO)=0.0010mol/(L·s) | D.υ(H2O)=0.045mol/(L·s) |
已知:强酸和强碱在稀溶液中发生反应时的中和热为57.3 kJ · mol-1,101 k Pa时辛烷的燃烧热为5518 kJ·mol-1。则下列热化学方程式书写正确的是
| A.H++OH-=H2O△H = -57.3kJ·mol-1 |
| B.2NaOH(aq)+ H2SO4(aq)= Na2SO4(aq)+2H2O(l)△H = -114.6 kJ·mol-1 |
| C.2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(g)△H = -11036 kJ·mol-1 |
| D.2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(l)△H = -5518kJ·mol-1 |
右图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3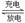 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
| A.当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL |
B.负极反应为4Na 4e-=4Na+ 4e-=4Na+ |
| C.闭合K后,b电极附近的pH变小 |
| D.闭合K后,a电极上有产生氢气 |
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g) Z(g)+W(s);ΔH>0则下列叙述正确的是
Z(g)+W(s);ΔH>0则下列叙述正确的是
| A.加入少量W,逆反应速率增大 | B.升高温度,平衡逆向移动 |
| C.当容器中气体压强不变时,反应达到平衡 | D.平衡后加入Z,上述反应的ΔH增大 |
在容积一定的密闭容器中发生可逆反应A(g)+2B(g)  2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是
2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是
| A.P1< P2,纵坐标指A的质量分数 |
| B.P1> P2,纵坐标指C的质量分数 |
| C.P1< P2,纵坐标指A的转化率 |
| D.P1< P2,纵坐标指混合气体的平均摩尔质量 |
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH4+的物质的量分别是
| A.2mol、3mol、4mol | B.2mol、3mol、8mol |
| C.3mol、2mol、8mol | D.3mol、2mol、4mol |