探究实验报告一:蜡烛及其燃烧的探究
探究实验的名称:蜡烛及其燃烧的探究
探究实验的目的:理解掌握蜡烛的有关性质知识
实验用品:蜡烛、火柴、 等
| 步骤和方法 |
现象 |
分析 |
|
| 点燃前[ |
|
蜡烛是白色蜡状固体,硬度小,稍有气味 |
|
| 用小刀切下一小块蜡烛投入水中 |
石蜡浮于水面 |
|
|
| 点燃蜡烛 |
|
蜡烛先熔化后气化,再燃烧;火焰明亮且明显分成三层 |
|
| 在烛焰上方罩一干燥烧杯 |
烧杯内壁出现水雾或水珠 |
|
|
| 在烛焰上方罩一个内壁沾有澄清石灰水的烧杯,振荡 |
烧杯内壁出现白色斑点 |
|
|
| 熄灭蜡烛 |
火焰熄灭,灯芯上产生一缕轻烟 |
轻烟为蜡烛蒸气冷却所致,遇明火可以燃烧。 |
结论:在通常情况下,蜡烛是白色蜡状固体,稍有气味,熔点、熔点较低,硬度较小,密度比水小。蜡烛在点燃条件下能燃烧,燃烧产物中有水和二氧化碳等。
问题和建议:为进一步说明蜡烛是先气化,然后是石蜡蒸气燃烧,可用一根尖嘴的细玻璃管插入焰心,然后在尖嘴处点燃。根据是否能点燃,可推断上述猜测是否正确。
某校化学小组同学从家中带来淀粉、食盐、纯碱、泡打粉、去污粉和部分变质的熟石灰6种固体物质。老师从中取出任意3种并编号,让小组同学通过实验确认分别为哪种固体。
【查阅资料】
1.该去污粉主要成分为碳酸钠和碳酸钙
2.该泡打粉的主要成分是碳酸氢钠和有机酸
3.熟石灰变质的原因是(用化学方程式表示)。
【实验准备】
为顺利完成任务,小组同学在老师指导下进行了如下预备实验。部分现象记录如下:
| 实验1 取样,加足量水充分溶解 |
实验2 取样,加入适量稀盐酸 |
|
| 淀粉 |
白色浑浊,试管底部有不溶物 |
无明显现象 |
| 泡打粉 |
有气体产生,试管底部有白色不溶物 |
有气体产生 |
【实验过程】
小组同学对老师提供的三种固体进行实验探究。部分现象记录如下:
| 实验1 取样,加足量水充分溶解 |
实验2 取样,加入适量稀盐酸 |
实验3 取实验1上层清液,加入3滴酚酞溶液 |
|
| 固体Ⅰ |
有气体产生,试管底部有白色不溶物 |
有气体产生 |
|
| 固体Ⅱ |
固体溶解,形成无色溶液 |
有气体产生 |
溶液变红 |
| 固体Ⅲ |
有白色浑浊,试管底部有白色不溶物 |
有气体产生 |
溶液变红 |
【得出结论】
1.固体Ⅱ、Ⅲ加水形成的溶液pH7 (填“>”、“<”或“=”);
2.分析以上实验现象得知,固体Ⅰ是,固体Ⅱ是。
3.小组同学通过讨论认为固体Ⅲ不能确定。请你设计确认该固体的实验方案。
【实验反思】
检验和鉴别也是实际生活中经常遇到的问题。面对多种物质的检验和鉴别,上述实验活动给我们的启示是。
课外小组同学利用下图所示装置制取二氧化碳,并对其性质进行研究。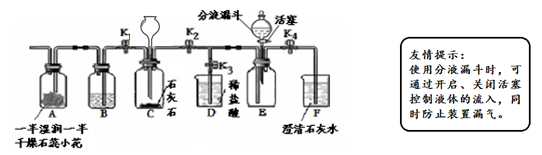
(1)若打开止水夹K1,关闭K2,从长颈漏斗向装置C中加入足量的稀盐酸,C中发生反应的化学方程式为。通过分析A中的现象可证明CO2具有的性质是。B中盛放的试剂是。
(2)若打开止水夹K2、K4,关闭K1、K3,从长颈漏斗向装置C中加入足量的稀盐酸,当观察到的现象时,证明E中CO2已集满。关闭止水夹K2、K4,打开K3,从分液漏斗向E中加入适量的氢氧化钠溶液。该实验中,能证明CO2与NaOH确实发生了化学反应的现象是。
实验是学习化学的一个重要途径。
(1)根据下图回答问题。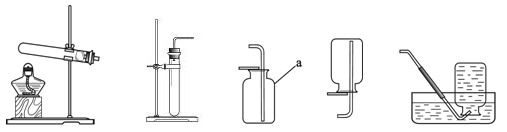
A B C D E
①仪器a的名称是。
②实验室用高锰酸钾制取氧气时,所选用的发生装置是(填字母序号,下同),收集装置是或E。用过氧化氢溶液和二氧化锰制取氧气的化学方程式为。
(2)实验室配制50g 5%的氯化钠溶液的操作示意图如图所示。其中玻璃棒的作用是。该实验的正确操作顺序为(填字母序号)。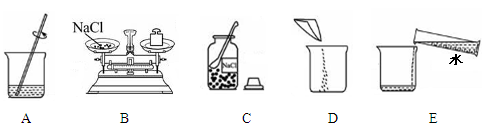
水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的性。
(2)下图实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为mL;反应的化学方程式是。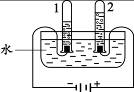
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为g。
(4)甲、乙两物质的溶解度曲线如右图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃t℃(填“>”、“<”或“=”)。
20℃时,对A试管进行如下操作,最终A试管中溶液
溶质的质量分数一定发生变化的是(填字母序号)。
A.加少量水 b.加入少量甲物质
c.升温到40℃ d.蒸发部分溶剂,恢复到20℃
e.加入少量40℃甲的饱和溶液,恢复到20℃
(6分)某化学兴趣小组的同学设计了如图所示的装置,探究影响化学反应速率的因素。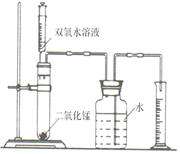
(1) 图中装置中使用注射器的优点是,观察量筒中液体的体积时视线要与。
(2)下面是用上述装置实验时,收集的相关数据:
| 实验 序号 |
H2O2溶液 的浓度/% |
H2O2溶液 的体积/mL |
MnO2的 用量/g |
温度/℃ |
收集O2的体积/mL |
反应所需 的时间/s |
| ① |
5 |
2 |
0.1 |
20 |
4 |
18 |
| ② |
10 |
2 |
0.1 |
20 |
4 |
6 |
| ③ |
30 |
8 |
/ |
40 |
2 |
64 |
| ④ |
30 |
8 |
/ |
60 |
2 |
25 |
由实验①和②对比可知.化学反应速率与 有关;
由实验③和④对比可知.化学反应速率与温度的关系是;
(3)化学反应的实质是构成物质的微观粒子相互碰撞、结合的结果.化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因:
。
(4)发现问题:实验时温度最难控制,反应一段时间后溶液的温度总是比起始时温度高,说明反应
热量。
(5)继续探究:
除了该实验小组探究过的因素以外,你若还有其他影响反应速率的因素及探究方法.请写在下面。若正确.本题另奖励4分,本试卷总分不超过60分。