下列关于物质的量浓度表述正确的是( )
| A.10 ℃时,0.35 mol·L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1 |
B.0.3 mol·L-1的Na2SO4溶液中含有Na+和 的总物质的量为0.9 mol 的总物质的量为0.9 mol |
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和 的物质的量相等,则K+和Cl-的物质的量浓度一定相同 的物质的量相等,则K+和Cl-的物质的量浓度一定相同 |
| D.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1 |
下列说法正确的是( )
| A.苯和苯乙烯是同系物 |
| B.乙醇和乙醚是同分异构体 |
| C.显酸性的有机化合物一定是羧酸 |
| D.纤维素、蛋白质、天然橡胶都是高分子化合物 |
下列化学用语使用正确的是( )
| A.葡萄糖、淀粉的最简式都是CH2O |
B.CH4的电子式是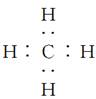 |
| C.乙醛分子的结构简式是CH3COH |
D.丙烷分子的球棍模型是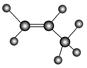 |
下列物质中,在常温常压时呈气态的是( )
| A.乙炔 | B.苯 | C.乙醇 | D.四氯化碳 |
化合物Z由如下反应得到: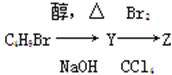 ,Z的结构简式不可能是( )
,Z的结构简式不可能是( )
| A.CH3CH2CHBrCH2Br | B.CH3CH(CH2Br)2 |
| C.CH3CHBrCHBrCH3 | D.CH2BrCBr(CH3)2 |
科学家艾哈迈德·泽维尔使“运用激光技术观察化学反应时分子中原子的运动”成为可能,在他的研究中证实了光可诱发下列变化: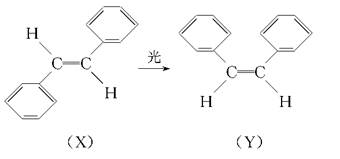
这一事实可用于解释人眼的夜视功能,有关X、Y的叙述不正确的是( )
| A.X和Y互为同分异构体 |
| B.X和Y分子中所有原子可以处于同一平面 |
| C.X和Y都可发生加聚反应 |
| D.该物质的同分异构体只有五种 |