某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下: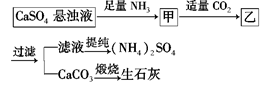
下列推断不合理的是( )
| A.向甲中通适量CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 molNH3 |
| C.CO2可被循环利用 |
| D.直接蒸干滤液能得到纯净的(NH4)2SO4 |
设NA为阿伏加德罗常数,下列叙述正确的是()
①7Li+中含有的中子数与电子数之比为2:1
②Cl2的摩尔质量与NA个Cl2分子的质量在数值和单位上都相等
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④活泼金属从盐酸中置换出1molH2,转移电子数为NA
⑤在C2H6分子中极性共价键与非极性共价键数之比为3:1
⑥500mL0.5mol·L-1Al2(SO4)3溶液中,含SO42-数目为0.75NA
⑦5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
⑧常温常压下,0.5 NA个一氧化碳分子所占体积是11.2L
| A.①②⑤ | B.②③⑧ | C.①③⑥ | D.③④⑦ |
在恒温、恒容的密闭容器进行反应有A(g)+B(g) C(g),若反应物的浓度从2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需的反应时间为()
C(g),若反应物的浓度从2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需的反应时间为()
| A.10s | B.大于10s | C.小于10s | D.无法判断 |
下列叙述不正确的是()
| A.低碳生活(low-carbon life)是一种时尚的生活理念,倡导减少温室气体排放。CO2、CH4等是常见的温室气体 |
| B.新型无机非金属材料用途广泛,人造刚玉用做高温炉管、氮化硅陶瓷可用于制造柴油机发动机部件 |
C.推广可利用太阳能、风能的城市照明系统,  积极推 积极推 行“限塑令”,加快研发利用二氧化碳合成的 行“限塑令”,加快研发利用二氧化碳合成的 聚碳酸酯类可降解塑料, 利于发展低碳经济、循环经济 聚碳酸酯类可降解塑料, 利于发展低碳经济、循环经济 |
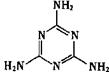
| D.“显世闻名”的奶粉事件中污染物为三聚氰胺(结构如图),其摩尔质量为126g |
在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是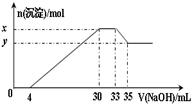
| A.x – y =" 0.01" mol |
| B.原溶液中c(Cl-)="0.75" mol·L-1 |
| C.原溶液的pH="1" |
| D.原溶液中n(Mg2+)∶n(Al3+)=5∶1 |
下列说法错误的是
| A.油脂、淀粉和蛋白质都是高分子化合物,它们在一定条件下都能水解 |
| B.植物及其废弃物可制成乙醇燃料,它是一种可再生能源 |
| C.含3个碳原子的有机物,每个分子中最多可形成3个C-C单键 |
| D.石油的分馏是物理变化;石油的裂化和裂解以及煤的干馏都是化学变化 |