甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。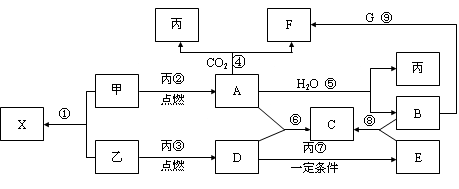
请回答:
(1)写化学式:丙_________,E________。
(2) X的电子式为____________________。
(3)写出A与H2O反应的化学反应方程式:__________________ _____________,反应中氧化剂是__________,1molA参加反应转移电子_____mol。
(4)写出反应⑨的离子方程式:___________ _____________。
(5)物质F的俗名是__________或_________,其溶液显_____性,原因是_______________________________(用一个离子方程式表示)
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
 ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn
②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。 请回答下列问题:
请回答下列问题:
 (1)Z2+ 的核外电子排布式是。
(1)Z2+ 的核外电子排布式是。 (2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。 (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。 a.稳定性:甲>乙,沸点:甲>乙
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙 c.稳定性:甲<乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙 (4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答) (5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(10分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的气态氢化物化学式为,它的沸点比PH3的沸点,
(填“高”或“低”)W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是______________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
。
(4)已知下列数据:
Fe(s)+1/2O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+3/2O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是______________________________。
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是,它是由键形成的分子。(填极性或非极性)
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为,
它的VSEPR模型是 ,分子构型是 。
有以下物质:①CH4,②C2H4,③H2O,④NH3,⑤CH2O,⑥CO2;
非极性分子的是______________;既有σ键又有π键的是__________;中心原子没有孤电子对的是______________;中心原子杂化类型为sp3的是;分子构型都是直线形的是。(写序号)
第四周期元素中,4p轨道半充满的是,3d轨道半充满的是,4s轨道半充满的是。(写元素符号)