I、金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③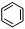
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO
(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 ;
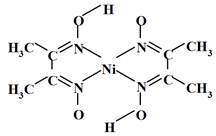
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。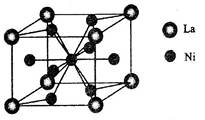
将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:。
B组:。
下列物质中(1)Na(2) Br2(3)Na2O(4)NO2 (5)CO2(6) SO3(7)NH3 (8)H2S(9)HCl (10)H2SO4(11)Ba(OH)2(12) NaCl (13)蔗糖 (14)NaCl溶液。
属于电解质的是, 属于非电解质的是 ,
能导电的是。(用序号填写)
过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填空:
| A.Na2O2 +2HCl= 2NaCl+H2O2 | B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 | D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)。
(3)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是:。
为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:
合成塔中反应的化学方程式为;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考 虑温度对反应速率的影响外,还主要考虑了。
虑温度对反应速率的影响外,还主要考虑了。
从合成塔分离出甲醇的原理与下列操作的原理比较相符(填字母)。
| A.过滤 | B.分液 | C.蒸馏 | D.结晶 |
(3)工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括。
(4)在体积为2L的合成塔中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2) =______________;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有。
(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知CH4(g)+2O2(g)=" CO2(g)+2H2O(l)" ΔH1=-890.3kJ/mol
H2 (g)+ O2(g)=" H2O(l)" ΔH2=-285.8kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________。
组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的基态原子核外电子排布式是,其第一电离能比O的________(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置。
(2)CO2是一种温室气体,它的电子式为,将其转变其他化工原料,必须 破坏的化学键属于(填“极性”或“非极性”)键。
破坏的化学键属于(填“极性”或“非极性”)键。
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系
。