氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 ,该反应的熵变⊿S 0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
①10min~20min以V(CO2) 表示的反应速率为 。
②该反应的平衡常数的表达式为:K= ,根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③下列各项能作为判断该反应达到平衡的是 (填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
(1)在人体血液中,HCO3-能起到稳定人体PH的作用,请用电解质溶液中的平衡解释:
(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1。c(CO32-)=0.075 mol·L-1,若t1时刻在上述体系中加入100 mL0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+ ,实线表示CO32-)。
A为芳香烃衍生物,只含C、H、O三种元素,苯环上有两个处于邻位的取代基。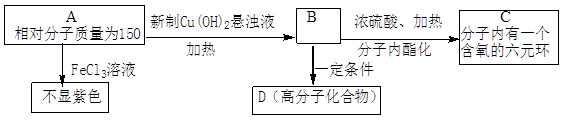
(1)B分子中含氧官能团的名称是。
(2)写出符合上述条件的A的两种可能的结构简式:;。
(3)等量的B分别与Na,NaOH,Na2CO3反应时,消耗三者物质的量之比是。
(4)符合上述条件的A,其中一种还可发生如下变化:
①A→ F的反应类型为。
②写出有关反应的化学方程式:
此A与新制Cu(OH)2悬浊液的反应:;
此A对应的B生成C的反应:。
1 molH2O中含有mol e—
0.1molNH4+中约含有个N,约含有个H.
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,其目的是: _____ ________。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:______________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。
(5)操作Ⅰ包括以下过程:过滤,用(填试剂化学式)溶解,蒸发浓缩,冷却结晶,洗涤获得产品。