复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
NaR |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H 2O +2NaClO===Na2CO3+2HClO 2O +2NaClO===Na2CO3+2HClO |
| B.CO2+H2O +NaClO===NaHCO3+HClO |
C.CO2 +H2O +NaR NaHCO3+HR NaHCO3+HR |
D.CO2 +H2O +2NaR Na2CO3+2HR Na2CO3+2HR |
E.Na2CO3+HR NaHCO3+NaR
NaHCO3+NaR
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号); 其pH为___________( 填数值);pH最大的是_________(填编号)。
填数值);pH最大的是_________(填编号)。
①HR ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:______________________;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是_______________________,
请写出反应的离子方程式:____________________________________________。
(13分)有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:
已知B的相对分子质量为60,分子中只含一个甲基。
C的结构可表示为: (其中:—X、—Y均为官能团)。
(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为_____________。
(2)官能团—X的名称为_______________;高聚物E的链节为____________。
(3)A的结构简式为__________________________。
(4)反应⑤的化学方程式为____________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式___________。
ⅰ.含有苯环 ⅱ.能发生银镜反应ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
(9分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件,Ph—代表苯基 )。
)。
(1)下列说法不正确的是________(填字母)。
A.反应①、④属于取代反应
B.化合物Ⅰ可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物Ⅰ
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为________(不要求写出反应条件)。
(3)反应③的化学方程式为______________________(要求写出反应条件)。
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体 。该同分异构体的分子式为________,结构式为_
。该同分异构体的分子式为________,结构式为_ _________________。
_________________。
(5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NC—CCl3反应成功合成了该物质。下列说法正确的是________(填字母)。
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4―→C+6N2↑
下表是A、B两种有机物的有关信息: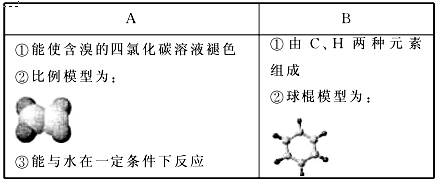
 根据表中信息回答下列问题:
根据表中信息回答下列问题:
(1)A与含溴的四氯化碳溶液反应的生成物的名称为________________;
写出在一定条件下,A与水反应的化学反应方程式___________。
(2)A的同系物用通式Cn Hm表示,B的同系物用通式Cx Hy表示,当A、B同系物分别出现同分异构体时,碳原子数最小值n =________,x =________。
(3)B具有的性质是______________(填序号)。
①无色无味液体;②有毒;③不溶于水;④密度比水大; ⑤与酸性KMnO4溶液和溴水反应使之褪色;⑥任何条件下不与氢气反应;⑦使溴水颜色变浅或褪色
为了测定某有机物A的结构,做如下实验:①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;②用质谱仪测定其相对分子质量,得如图一所示的质谱图;③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1:2:3。试回答下列问题:
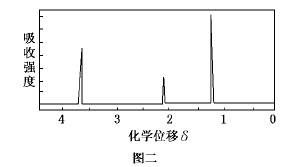
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)能否根据A的实验式确定A的分子式________(填“能”或“不能”),若能,则A的分子式是________(若不能,则此空不填)。
(4)写出有机物A可能的结构简式________。
如图是由4个碳原子结合成的五种有机物(氢原子没有画出)
(1)写出有机物(a)的系统命名法的名称________。
(2)有机物(a)有一种同分异构体,试写出其结构简式____________。
(3)上述有机物中与(c)互为同分异构体的是________(填代号)。
(4)任写一种与(e)互为同系物的有机物的结构简式______ __________。
__________。
(5)上述有机物中不能与溴水反应使其褪色的有________(填代号)。
(6)(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有
(填代号)。