已知醛在一定条件下可以发生如下转化: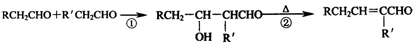
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题: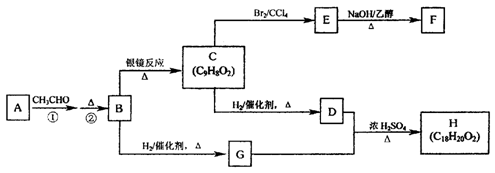
(1)A、B的结构简式为:A B 。
(2)G、D反应生成H的化学方程式是: 。
(3)一定条件下,能够与1molF发生反应的H2的最大用量是 mol。
(4)G有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的同分异构体的结构简式为: 。
(6分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。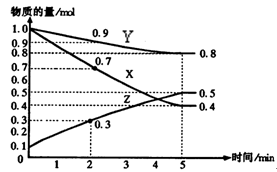
(1)由图中的数据分析,该反应的化学方程式为;
(2)反应开始至5minZ的平均反应速率为;
(3)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。
已知有五种元素的原子序数的大小顺序为C > A> B> D > E;A和C同周期,B和C同主族;A和B形成离子化合物A2B 中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子.试回答下列问题:
(1)写出以下元素的名称: ABE
(2)用电子式表示离子化合物A2B 的形成过程:
(3)写出D元素形成单质的结构式:
(4)写出下列物质的电子式:E与B形成的化合物:
A、B、E形成的化合物:
(5)A和B两元素形成的化合物A2B2中存在的化学键的类型是。
乙烯与乙烷的混合气体共a mol,与b mol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)=________。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前氧气的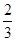 时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
(3)a的取值范围为________。
根据下面的反应路线及所给信息填空。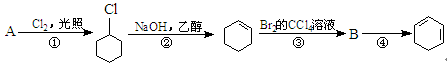
(1)A的结构简式是,名称是。
(2)①的反应类型是;②的反应类型是。
(3)反应④的化学方程式是 。
Ⅰ.麻黄素又称黄碱,是我国特定的中药材麻黄中含有的一种生成碱。经我国科学家研究发现其结构如下:
(1)麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
(2)下列各物质:
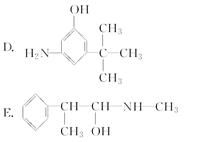
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
Ⅱ.某烃类化合物A的相对分子质量为84,分子中含有一个碳碳双键,其分子中只有一种类型的氢原子。
(1)A的结构简式为______________________;
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)