在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为: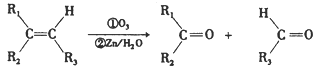
已知:
①合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或NaOH溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与NaOH溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2)。
请根据上述信息,完成下列填空:
⑴写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中的一组)
A______________,C_____________,E________________.
⑵写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式:______________________________________________
非金属元素R,其单质4.8g在氧气中充分燃烧生成RO29.6g,在R原子中,核内质子数等于中子数,则R的元素名称为,其最高价为,与左右相邻元素比较,R的氢化物比稳定,R的最高价氧化物的水化物酸性比弱。
如图甲、乙是电化学实验装置。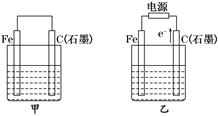
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为____________________________________________。
②乙中总反应的离子方程式为______________________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为__________________________________________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为____________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________ g。
(10分)甲、乙两位学生分别对淀粉的水解情况进行了探究实验。
【提出假设】淀粉在一定条件下可以水解
【实验过程】学生甲在一支试管中放入0.5 g淀粉后,再加入质量分数为20%的硫酸溶液,加热10 min后,再将溶液一分为二,其中一份溶液做银镜反应实验,结果无银镜出现,另一份溶液加入碘水,结果无蓝色出现;学生乙在一支试管中放入0.5 g淀粉后,再加入质量分数为20%的硫酸溶液少许,加热45 min后,加入过量的NaOH溶液中和硫酸,再将溶液一分为二,其中一份溶液做银镜反应实验,结果有银镜产生,另一份溶液中加入少量碘水,未出现蓝色。
【实验分析】(1)淀粉水解的过程中发生的化学反应是:
_________________________________________________________________________。
(2)学生甲的实验操作不正确的地方是__________________________________________。
根据甲的实验现象,淀粉的水解情况是_________________。
A.完全水解 B.部分水解 C.没有水解 D.不能准确判断
(3)学生乙的实验操作不正确的地方是__________________________________________。
根据乙的实验现象,淀粉的水解情况是________________。
A.完全水解 B.部分水解 C.没有水解 D.不能准确判断
(10分)普通玻璃是 (混合物、纯净物)玻璃可在一定温度范围内软化,制成工艺品等。这是因为玻璃是一种物质,没有固定的 。盛强碱溶液的磨口试剂瓶都不能用玻璃瓶塞的原因是
。
变色眼镜的玻璃片中含有少量的溴化银和微量氧化铜。当玻璃受到阳光照射时,因为发生反应(用化学方程式表示),而使玻璃由无色变为暗棕色。
(6分) A、B两种溶液,一种是植物油,一种是矿物油。现各取少量,放在两只洁净的试管里,加入NaOH溶液并加热,冷却后加水振荡,A出现泡沫,B无明显现象。由此可推出:A为________________,B为________________;理由是____________________________________________________________________________________________________________________________________________________。