在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,下图所示是其电流(I)随新物质加入量(m)的变化曲线。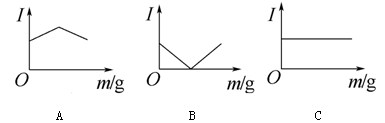
以上4个导电性实验,其中与A图变化趋势一致的是__________,与B图变化趋势一致的是__________,与C图变化趋势一致的是__________。
①Ba(OH)2溶液中滴入H2SO4溶液至过量 ②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量 ④NH4Cl溶液中逐渐加入适量NaOH固体
(1)除去亚铁离子中混有的铁离子用试剂______,离子方程式_______________________
(2)除去混在氯化钠(NaCl)中的少量氯化镁(MgCl2), 用_____________(试剂),离子方程式是___________________________
由等物质的量烃A和烃的衍生物B组成的混合物共0.5摩,恰好能和1.25摩O2完全燃烧生成1molCO2和1molH2O,请用分子式给出A和B的可能组合方式(可不填满)
| A |
B |
|
| (1) |
||
| (2) |
||
| (3) |
||
| (4) |
||
| (5) |
(12分)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
写出反应②③的化学方程式:____________________、____________________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有_____种。
(3)锥形瓶C中观察到的现象______________。
(4)写出C中逸出的气体在工业上的两种用途:________________、_______________。
课本的第27页介绍了一种热带雌蚕蛾为了吸引同类雄蛾会分泌出叫“蚕蛾醇”的物质。蚕蛾醇有多种顺反异构体,如
请回答:
(1)蚕蛾醇共有多少种顺反异构体(含自身)。
(2)该蚕蛾醇手性碳原子数为。
(3)该蚕蛾醇的分子式为。
(4)该蚕蛾醇不具有的性质是(从下面序列中选择序号填入)
①酯化②氧化③加聚④加成⑤NaOH中和反应
(1)某合成物的结构简式为 ,则合成它的单体为_____________________________________。
,则合成它的单体为_____________________________________。
(2)烯烃在一定条件下被氧化时,由于碳碳双键断裂,转化为醛或酮,如: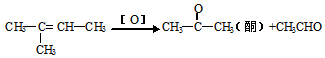
若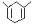 在发生上述反应时其产物的结构产物为______________________
在发生上述反应时其产物的结构产物为______________________
(3)写出苯与液溴在FeBr3催化下制溴苯的化学反应方程式: