t℃时,将3mol A和1mol B气体通入容积为2L的密闭容器中(容积不变),发生如下反应3A(G)+B(x) xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8mol B,并测得C的浓度为0.4mol·L-1。请填写下列空白:
xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8mol B,并测得C的浓度为0.4mol·L-1。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为____________________。
(2) x = ____。
(3)若向原平衡混合物的容器中再充入a molC, 在t℃时达到新的平衡,此时B的物质的量为n(B) = ___________mol。
(4)保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是______(填字母)。
A.均减半 B.均加倍 C.均增加0.4 mol D.均减少0.4 mol
(5)如果上述反应在相同温度和容积的容器中进行,起始加入3 molA和3mol B,达到平衡时A的体积分数为a%。其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是 (填字母)。
A .2 molC B.1molA、3molB和4molC
C.1mol B和4molC D.6molA和2molB
亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]是一种重要化学试剂,实验室可用纯铁片来制取硫酸亚铁铵,流程如下:
请回答下列问题:
(1)操作Ⅰ的名称是 ,所用主要仪器和用品有(铁架台、铁圈除外) 。
(2)若A物质为CuSO4,其加入的目的是 ,则固体B的成分为 。
(3)加少量硫酸可以调节pH为 1~2,其作用是 。
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。

请用化学用语回答下列问题: (1)D元素在周期表中的位置:
(1)D元素在周期表中的位置:
(2)A、D 、E元素简单离子半径由大到小的顺序为_____>______ >______ (填微粒符号 ) (3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式 ,该阳离子中存在的化学键有 。 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(6) 化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是 。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+
c.m1一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大。X,Y两元素最高正价与最低负价代数和均为0;Q与X同主族;Z是地壳中含量最高的非金属元素,R的简单离子在同周期离子中半径最小。请回答下列问题:
(1)画出Z的原子结构示意图 ,工业上制取R单质的化学方程式为
(2)已知,由X,Y两种元素组成的相对分子质量最小的化合物W 3.2g在氧气中完全燃烧生成稳定化合物(常温常压下)放出178.06KJ的热量,写出W燃烧的热化学方程式
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系: (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为
②如果A,B均为由以上某些元素组成的盐,则A溶液显 性,原因是(用离子方程式表示) 。浓度均为0.1mol/L的A,B的溶液等体积混合,混合溶液中离子浓度由大到小的顺序为 。
某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下: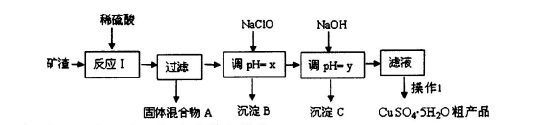
已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: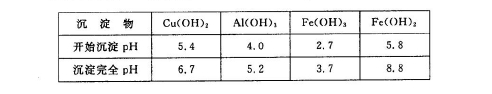
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是 (写2点)。
(2)固体混合物A中的成分是 。
(3)反应I完成后,铁元素的存在形式为 (填离子符号);写出生成该离子的离子方程式 。
(4)操作1主要包括: 、 、 。洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是 。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为 .。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 。
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。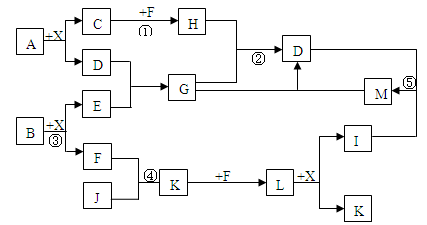
(1)写出化学式:A ,E ,L ;
(2)在反应①②③④⑤中属于氧化还原反应的是 ;
(3)反应③化学方程式为: ;
(4)写出下列离子方程式:反应② ;
G溶液与M溶液的反应 。