I.对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是
| A.SiX4难水解 | B.SiX4是共价化合物 |
| C.NaX易水解 | D.NaX的熔点一般高于SiX4 |
II.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60.碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____ 、____ 。
(3)C60属于___ _ 晶体,石墨属于____ 晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的____ 共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。
(5)金刚石晶胞含有____个碳原子。
(12分)甲、乙、丙、丁四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
Cl-、SO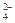 、NO3-、OH- 、NO3-、OH- |
现进行以下实验,
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出电解质的化学式:甲乙
(2)丙的阴离子的电子式是,丁的阳离子的结构示意图是;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合:
②乙溶液与丁溶液混合:
在一个容积不变的反应容器中,可以通过调节温度使下列反应:A(g)+2B(g) 2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
(1)若X=5.5时需要降低体系温度才能使反应达平衡时符合题设条件,则正反应为_________反应。(填“吸热”或“放热”)
(2)欲使该反应起始时维持逆向移动,则X的取值范围_________________________。
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
根据题意完成下列填空:
(1)在地壳深处容易有气体逸出,在地壳浅处容易有沉积。
(2)如果上述反应的平衡常数K值变大,该反应(选填编号)。(3分)
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为。(3分)
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。
实验步骤:将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A.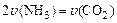 |
B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
(2)根据表中数据,计算25.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应
SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。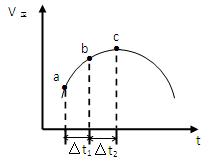
(1)点a-c段,速率变化的主要原因是,点c后速率变化的主要原因是。
(2)c点是否已经达到平衡状态(填“是”、“否”或“不一定”)
(3)反应物浓度:a点b点(填“<”、“=”或“>”)
(4)反应物的总能量生成物的总能量(填“<”、“=”或“>”)
(5)△t1=△t2时,SO2物质的量的变化量:a~b段b~c段(填“<”、“=”或“>”)