2SO2(g)+O2(g)=2SO3(g)  H=" -198" kJ·mol-1反应过程的能量变化如图所示。请回答下列问题:
H=" -198" kJ·mol-1反应过程的能量变化如图所示。请回答下列问题: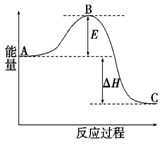
⑴E的大小对该反应的反应热有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ;
⑵图中 H= kJ·mol-1;
H= kJ·mol-1;
⑶如果反应速率v(SO2)为0.05 mol·L-1·min-1则v(O2)= mol·L-1·min-1;
v(SO3)= mol·L-1·min-1;
三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____、乙____ ,C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是__________。
(2)写出反应②的化学方程式: ____________________。
A、B、C、D四种物质都含有同种元素且有如图所示转化关系。试回答下列问题:
(1)若A是一种常见非金属,且是一种半导体材料。写出下列反应的方程式。
①B→D的化学方程式:__________________________________________________;
②A→C的离子方程式:__________________________________________________。
(2)若A是一种常见金属,此时酸为强酸。写出:A→D的离子方程式:__________________________。
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
(1)A点的沉淀物的化学式为。
(2)写出A点至B点发生反应的离子方程式:。
(3)原混合物中NaOH的质量是g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为mL。
实验室可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“双线桥”标出电子转移的方向和数目;
②该反应中被氧化和未被氧化的HCl的物质的量之比是 _______。
将0.1 mol的MnO2和40 mL 10 mol·L-1的浓盐酸混合后加热,充分反应后,向所得溶液中加入足量的AgNO3溶液。在此过程中:
(1)产生的Cl2在标准状况下的体积V(Cl2)为______(填写体积范围);
(2)产生的AgCl沉淀的物质的量为______ (假设盐酸不挥发,且产生的Cl2的物质的量为a mol)。