(15分)对下图中两极加以必要的连接并填空:
(1)在图A中,使铜片上产生氢气。
①若加以导线连接,则连接后的装置叫 (填“原电池”或“电解池”)。锌片发生 (填“氧化”或“还原”);铜片上的电极反应式: 。
②若外加电源,则连接后的装置叫 (填“原电池”或“电解池”),其中铜片作为该装置的 极,连接电源的 极;锌片上发生的电极反应式为 。
(2)在图B中,使a极析出铜。
①若a、b电极均为石墨电极并加以必要的连接,则连接后的装置应为 (填“原电池”或“电解池”);该装置工作时,溶液中阴离子向 极作定向移动(填“a”或“b”);经过一段时间后,停止反应并搅匀溶液,溶液的酸性 (填“增强”、“降低”或“不变”)。
②若a、b电极加以导线连接,且a极为铜电极,则b极可以为 电极(填序号)。
| A.铂 | B.铁 | C.石墨 | D.银 E.锌 |
该装置工作时,溶液中阴离子向 极作定向移动(填“a”或“b”)。
下表是元素周期表的一部分,请依据该表回答问题。
| 族 周期 |
IA |
0 |
||||||
| 1 |
H |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
He |
| 2 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)下列说法正确的是
| A.可用于半导体材料的元素是碳 |
| B.PH3的稳定性比H2S强 |
| C.第VA族元素的最高价氧化物对应的水化物化学式均为H3RO4 |
| D.H2SiO3的酸性比H3PO4弱 |
E.NaOH的碱性比Mg(OH)2强
(2)第2周期VIIA族元素的原子结构示意图是_______________,该元素与同周期IA族元素组成的化合物类型是。_______________
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是_______________(填化学式,下同);碱性最强的是 _______________;具有两性的是_______________。
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。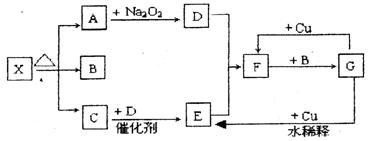
(1)写出下列各物质的化学式:
X:;B:;F:;G:。
(2)写出下列变化的反应方程式:
A→D:;
G→E:。
(3)实验室里,常用加热的混合物的方法制取气体C,常采用法来收集。
化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:。
(2)现有一瓶胃舒平药片(复方氢氧化铝),请设计实验验证其主要成分。(写出实验步骤和实验现象):
将药片碾碎,,则说明其主要成分为氢氧化铝。
(3)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:_________________ ______。
检验Fe3+常用的试剂除碱外,还可以用(填化学式),现象是。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为;漂白粉的有效成分是(填化学式)。该反应中氧化剂与还原剂物质的量之比是 __________。
有机物A的结构简式为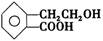 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。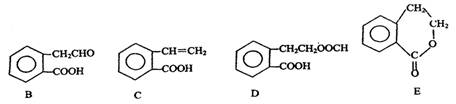
请回答下列问题:
(1)指出反应的类型:A→C:。
(2)在A~E五种物质中,互为同分异构体的是(填代号)。
(3)写出由A生成B的化学方程式
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出D与NaOH溶液共热反应的化学方程式
。