下列关于热化学反应的描述中正确的是( )
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)  2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol 2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
在水溶液中能大量共存的一组离子是
| A.NH4+、Ag+、SO42-、Cl- | B.Fe2+、NO3-、Ba2+、H+ |
| C.K+、CO32-、Cl-、OH- | D.Na+、Al3+、AlO2-、CO32- |
下列关于有机物的说法正确的是
A.羟基的电子式: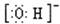 |
B.丙烷的球棍模型为: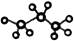 |
C.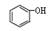 和 和 互为同系物 互为同系物 |
D.邻甲基苯甲酸的结构简式: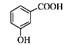 |
下列说法正确的是
| A.淀粉、纤维素、油脂均属于高分子化合物 |
| B.煤经过气化和液化等物理变化可转化为清洁燃料 |
| C.蛋白质水解的最终产物是多肽 |
| D.石油的催化裂化主要是为了提高从石油得到的汽油等轻质油的产量 |
4.6g铜和镁的合金完全溶于浓硝酸,反应后硝酸被还原只生成4480mL的NO2气体和336mL的N2O4气体(气体体积都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
| A.9.02g | B.8.51g | C.8.26g | D.7.04g |
下列有关物质的性质、反应现象的描述及其原理解释均正确,且符合因果关系的是
| 选项 |
物质的性质或反应现象 |
原理解释 |
| A |
SO2通入溴水,溴水褪色 |
SO2有漂白性 |
| B |
碱性:NaOH>Al(OH)3 |
金属性:Na>Al |
| C |
白磷比N2的性质活泼 |
非金属性:P>N |
| D |
少量Na投入CuSO4溶液中,Na可以置换出Cu |
活泼性:Na>Cu |