用98 %的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒②10 mL量筒③50 mL烧杯④托盘天平⑤100 mL容量瓶⑥胶头滴管⑦玻璃棒,按使用仪器的先后顺序排列正确的是
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
在下列各溶液中,离子一定能大量共存的是
| A.强酸性溶液中:K+、Al3+、CH3COO-、SO42- |
B.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO 、Br-、Ba2+ 、Br-、Ba2+ |
| C.室温下,pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
下列叙述正确的是
| A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: 2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-) |
| B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生 |
| C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 |
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中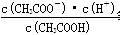 大于K 大于K |
下列各离子方程式中,属于水解反应且使溶液显碱性的是
| A.CH3COOH+OH-= CH3COO-+H2O |
B.H2O+H2O  H3O++OH- H3O++OH- |
C.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
D.PO43-+H2O  HPO42-+OH- HPO42-+OH- |
一定条件下反应2AB(g) A2(g) +B2(g),不能确定达到平衡状态的是
A2(g) +B2(g),不能确定达到平衡状态的是
| A.单位时间内生成n mol A2,同时生成2n molAB |
| B.单位时间内生成n mol B2,同时生成2n molAB |
| C.AB的消耗速率等于A2的消耗速率 |
| D.容器中各组分的物质的量分数不随时间变化 |