Ⅰ.过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
⑴写出H2O2的电子式_________________,其分子内存在______键和_______键。
⑵你认为H2O2被成为“绿色氧化剂”的主要原因是________________________________________。
⑶与H2O2分子具有相同电子数的双原子单质分子为(写化学式)______________,与H2O2分子具有相同电子数的三原子化合物分子为(写化学式)______________。
⑷某工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式为___________________________________________,反应中H2O2作_____________剂。
⑸将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为___________________________________________,反应中H2O2作_____________剂。
⑹双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里:
MnO4-+ H2O2+ H+=== Mn2++ H2O+ 。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→ O2
⑴该反应的化学方程式为_____________________________________________。
⑵如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(Ⅰ)某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如下:
请填写下列空白:
(1)A的化学式是 。
(2)振荡的目的是 。
(3)分液操作需要的玻璃仪器有 。
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式: 。
(Ⅱ)甲苯和溴乙烷混合物可通过如下流程进行分离。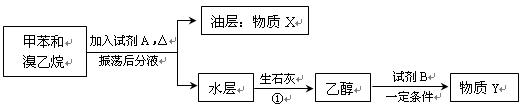
请填写下列空白:
(1)试剂A的名称为 。
(2)写出在甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式: 。
已知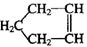 可简写为
可简写为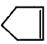
Ⅰ.降冰片烯的分子结构可表示为: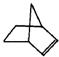
(1)降冰片烯属于__________。
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
Ⅱ.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为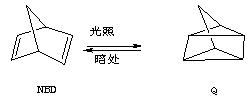
(1)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为,系统命名为。
(2)四环烷(Q)一氯代物共有种。
影响化反应速率的因素很多,某校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响化学反应速率的因素。
甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②___________________ |
反应速率Fe>Mg,Cu反应 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________;
(2)甲同学的实验目的是_________________________;要得出正确的实验结论,还需要控制实验的条件是_____________________________;
乙同学为了更精确地研究浓度对反应速率的影响,
利用右图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是_________________________;
(4)乙同学完成该实验应选用的实验药品是_________________________。
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置;化合物M中含有的化学键类型有__________________________;用电子式表示化合物DA的形成过程:________________________________________________
(2)比较B、C、E形成的气态氢化物的稳定性(用化学式表示):>>;写出C与A形成的18e-化合物的电子式;
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:
____________________________________________________;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为__________________________。
(1)写出一个能证明还原性Fe比Cu强的离子方程式:
;
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液)
;
(3)若该电池中两电极的总质量为60 g,工作一段时间后,取出两电极洗净干燥后称量,总质量为46 g,则反应过程中转移电子的数目为。