下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
(4)反应④的离子方程式是:______________________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:___________________________________。
在空气中切开一块金属钠,可看到断面呈色,具有,但断面很快变,主要是由于生成一薄层,若把钠放在石棉网上加热可观察到,反应的化学方程式为,其中还原剂为。若把1.15g钠放在足量的氯气中燃烧,生成氯化钠的质量是g,反应方程式是。
某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL 5 mol/L HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是_____________。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是_____________mL,沉淀的最大质量是_____________g(用含a的代数式表示)
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数______________。
⑴加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。(列出计算过程)
⑵过氧化钠与铝粉混合物共18.3g,加入100ml 水,充分反应后混合物完全溶解,并收集到5.6L气体(标准状况).则收集到的气体成份是,体积比是。
某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题: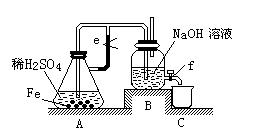
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:,B中可以观察到的现象是。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是,
有关反应的化学方程式是
物质有以下转化关系: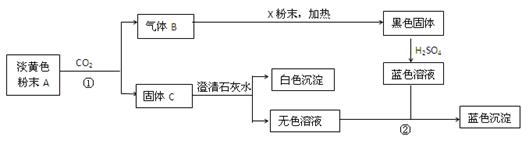
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是,B是,C是,X粉末是。
(2)写出反应①的化学方程式。
(3)写出反应②的离子方程式。