某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知:
BaSO4(s)+4C(s) 4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
下列说法不正确的是( )
| A.上述反应中BaSO4均作氧化剂 |
B.反应C(g)+CO2(g) 2CO(g)的ΔH3>+172.5 kJ·mol-1 2CO(g)的ΔH3>+172.5 kJ·mol-1 |
| C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 |
| D.以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
对于反应:C2H4(g)=C2H2(g)+H2(g),2CH4(g)=C2H4(g)+2H2(g),当升高温度时都向右移动。①C(s)+2H2(g)=CH4(g) ΔH1;②2C(s)+H2(g)=C2H2(g)ΔH2;③2C(s)+2H2(g)=C2H4(g) ΔH3。则①②③中ΔH1、ΔH2、ΔH3的大小顺序排列正确的是( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 | C.ΔH2>ΔH1>ΔH3 | D.ΔH3>ΔH2>ΔH1 |
已知:
①I2(g)+H2(g) 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g) 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是( )
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.I2(g)=I2(s) ΔH=-17.00 kJ/mol |
| C.固态碘的稳定性比气态碘的稳定性高 |
| D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多 |
已知:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
| A.碳的燃烧热大于110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
反应A(g)+B(g)―→C(g) ΔH,分两步进行:①A(g)+B(g)―→X(g) ΔH1;②X(g)―→C(g) ΔH2。反应过程中能量变化如图1所示,E1表示A+B―→X的活化能,下列说法正确的是( )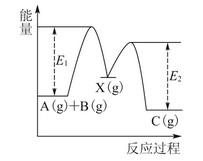
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)―→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |