某学校科学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:①取5只250mL集气瓶,向5只集气瓶中分别装入25mL、50mL、75mL、100mL、125mL的水,并用毛玻璃片盖住,依次编号为1、2、3、4、5。②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1-5号瓶中的水排去。③将带火星的木条依次插入1-5号瓶中,把观察到的现象和计算数据,填入下表。
| 集气瓶标号 |
1 |
2 |
3 |
4 |
5 |
| 集气瓶中收集氧气的体积 |
25mL |
50mL |
75mL |
100mL |
125mL |
| 带火星木条的状况 |
微亮 |
亮 |
很亮 |
复燃 |
复燃 |
试回答下列问题:
⑴从观察到的现象知,使带火星的木条复燃所需氧气的最小体积分数介于( )号瓶至( )号瓶之间:
⑵实验室中采用分解过氧化氢的方法制取氧气,其反应的文字表达式为
,反应类型属于
⑶根据以上实验事实,下列说法中正确的是
A.只有在纯氧中才能使带火星的木条复燃
B.集气瓶中氧气的体积分数≥52.6%时,带火星的木条就能复燃
C.只要有氧气存在就可使带火星的木条复燃
⑷当4号瓶收集氧气为100 mL时,那么瓶中实际氧气所占的体积分数为 %
上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈。(如你能再设计一个实验来说明此问题可奖励2分)。
某兴趣小组的同学为探究实验室久置的氢氧化钠固体的成分,进行了有关实验,请你与他们完成以下探究:
【提出猜想】猜想I:全部是氢氧化钠;猜想II:全部是碳酸钠;猜想III:_________________。
【实验验证】
(1)请完成猜想III;
(2)溶液1中加足量稀盐酸,产生无色、无味的气体,说明原固体中含有_________;
(3)溶液2中滴加过量BaCl2溶液的目的是____________________________,反应的化学方程式为。
(4)由以上实验现象可知猜想_______正确;
(5)久置的NaOH固体变质的原因是(用化学方程式表示)____________________。
某化学兴趣小组的同学在做完硫酸铜溶液和氢氧化钠溶液反应实验后,对浑浊液过滤,得到无色澄清的滤液。
(1)对滤液中溶质的成分,同学们进行了如下猜想:
猜想一:硫酸钠
猜想二:硫酸钠与氢氧化钠
猜想三:硫酸钠与硫酸铜
经过讨论,同学们一致认为猜想不成立,理由是。
(2)请你选择一种可能的猜想,进行验证,简要写出实验步骤和现象。
九年级化学兴趣小组的同学们用K2SO4、KCI、NH4 HCO3、NH4Cl四种固体,通过混合两种固体药品的办法自制“钾,氮复合肥料”,同学们制得了成分不同的“钾,氮复合肥料”,从中抽取一份作为样品探究其成分,请回答有关问题:
限选试剂:稀HCI,稀H2 SO4,BaCI2溶液,AgNO3浴液,蒸馏水
(1)【做出猜想】
猜想1:K2SO4和NH4 HCO3;
猜想2:K2SO4和NH4Cl;
猜想3:KCI和NH4 HCO3;
猜想4:______________。
(2)【设计方案】
①甲同学提出先用AgNO3溶液确定是否含有KCl,你是否同意并说出理由:__________________
②乙同学提出先确定是否含有NH4 HCO3,则可以选择的试剂是__________________。
(3)【实验探究】(提示:碳酸氢钡溶于水)
| 实验操作 |
预期现象 |
结论 |
| 步骤1:__________________ |
_________________________ |
猜想2成立 |
| 步骤2:__________________ |
_________________________ |
(4)将含有可溶性杂质的某氯化钾样品3g溶于足量水中,再向所得溶液中滴人200g AgNO3溶液(杂质不与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示。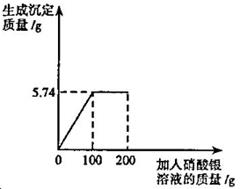
计算:硝酸银溶液中的溶质的质量分数是多少?
请你参与某学习小组研究性学习的过程,并协助完成相关任务。
【研究课题】探究X物质的成分。
【查阅资料】(1)X物质可能由Ca(HCO3)2、Mg(HCO3)2、Ca(OH)2、Mg(OH)2、CaCO3、BaCO3中的一种或几种组成。
(2)X物质是通过过滤水溶液得到的沉淀。
(3)相关物质的溶解性如下表:
| 物质 |
Ca(HCO3)2 |
Mg(HCO3)2 |
Ca(OH)2 |
Mg(OH)2 |
CaCO3 |
BaCO3 |
| 溶解性 |
可溶 |
可溶 |
微溶 |
不溶 |
不溶 |
不溶 |
【设计并实施方案】
(1)由查阅资料可知X物质肯定不含可溶性的Ca(HCO3)2、Mg(HCO3)2。
(2)甲同学在烧杯中放入少量研碎的X物质,加入足量蒸馏水充分搅拌,静置。取上层清液滴入Na2CO3溶液,没有白色沉淀,说明X物质中无(填化学式)。
(3)乙同学设计了下列实验装置,想进一步确定X物质的成分。
其主要实验步骤如下:
①按图组装仪器,关闭活塞b,将50gX物质的粉末放入锥形瓶中,逐滴加入足量稀硫酸,充分反应。
②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气;
③称量D瓶内物质明显增加的质量;
④继续鼓入空气,直至D瓶内物质质量不变;
⑤经称量,D瓶内物质增加的质量为20g。
【评价】(1)A瓶中的NaOH溶液起到作用。若A瓶中无NaOH溶液,D瓶中的质量将(填“增大”、“不变”或“减小”)。
(2)分析X物质的可能组成是(有几种写几种)。
过氧化钠(Na2O2)可用作呼吸面具的供氧剂.实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究.
【查阅资料】1.过氧化钠能与空气中水和二氧化碳反应生成氧气:
2Na2O2+2H2O=4NaOH+02↑, 2Na202+2C02==2Na2CO3+O2.
【提出问题】1.过氧化钠是否变质?
【猜想与假设】
假设1:过氧化钠未变质;假设2:过氧化钠部分变质;假设3:过氧化钠全部变质.
【实验探究】
【提出新问题】部分变质的过氧化钠中是否含有氢氧化钠?
【实验探究】③取少量①中溶液于试管中,加人足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,溶液变红.
【定性分析】
(1)由实验③可以确定①中溶液含有的溶质是_______(填化学式);
(2)小明认为,由上述实验无法确定原固体样品中是否含有氢氧化钠,理由是_________。
【定量研究】称取6.04g的过氧化钠样品于锥形瓶中,加入足量的蒸馏水,共收集到气体0.64g,再向上述锥形瓶中加入足量的澄清石灰水,充分反应后,经过沉淀、过滤、干燥等,得到固体2.00g。
(1)写出加入澄清石灰水的反应方程式_____________________
(2)6.04g上述样品中,含氢氧化钠的质量_______________。
【反思与提高】过氧化钠长期暴露在空气中,最终会变质为(填化学式)