将一小块金属钠长期露置于空气中发生一系列变化,最终产物是
| A.NaOH | B.Na2CO3 | C.NaCl | D.Na2O2 |
市场上销售的“84”消毒液,其商品标识上有如下叙述: ①本品为无色溶液,呈碱性②使用
时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣服。则其有效成份可能是
| A.Cl2 | B.SO2 | C.NaClO | D.KMnO4 |
下列有关钠的叙述中,错误的是
| A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 |
| C.钠是一种灰黑色的固体 |
| D.钠的质地较软,可用小刀切割 |
下列科研成果不是由我国发明或创造的是
| A.世界上第一个由人工合成的、具有生理活性的蛋白质——结晶牛胰岛素 |
| B.黑火药和造纸 |
| C.发现元素周期律 |
| D.世界上首次人工合成的酵母丙氨酸转移核糖核酸 |
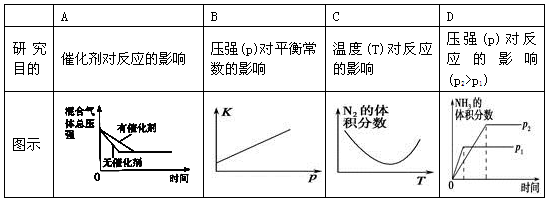
对于可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是