(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250°C |
300°C |
350°C |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度 D.恒容充入H2
E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
| 平衡 时的 数据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
akJ |
bkJ |
ckJ |
|
| 体系压强(Pa) |
p1 |
p2 |
p3 |
|
| 反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为
A.c3>2c1 B.c1<c3<2c1 C.c1=c2
②a、b、c的关系表达正确的为
A.c<2|△H| B.a+b=|△H| C.c=2b
③p1、p2、p3的关系不正确的为
A.p1=p2 B.p2<p3<2p2 C.p3>2p2
④α1、α2、α3的关系表达不正确的为
A.α1=α2 B.α3<α2 C.α1+α2="1"
已知有以下物质相互转化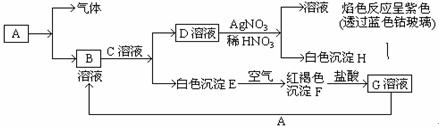
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式。
有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103。它们之间有下列的转化关系:
①A+NaOH→D+H2O②B→A + H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
+ H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
⑴写出A、B、C、D的化学式:
A,B,C,E 。
。
⑵写出①③④的离子方程式:
①,
③,
④。
2004年国家食品监督局发出公告“警惕油炸食品中的丙烯酰胺(CH2=CH—CONH2)”,丙烯酰胺对人体可造成神经毒性和遗传毒性。下图流程中的有机物K是丙烯酰胺的相邻同系物。
请回答下列问题:
(1)①~⑦反应中属于加成反应的有,属于消除反应的是。
(2)写出反应条件②。
(3)写出结构简式B,H。
(4)写出下列反应的化学方程式:
C→D
E→F
水杨酸是合成阿斯匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:
。
(3)写出水杨酸与碳酸氢钠反应的化学方程式:
(4)在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
则阿斯匹林的分子式为;1摩尔阿司匹林完全水解需要氢氧化钠溶液____摩尔。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)
1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2)=c(H2O) d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡:②加入少量灼热的碳粉,则平衡:__
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性____,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是。